
| n(SO32-):n(HSO3-) | 91:9 | 1:1 | 9:91 |
| pH | 8.2 | 7.2 | 6.2 |

分析 (1)①二氧化硫和氢氧化钠反应生成亚硫酸钠和水,注意弱电解质写化学式;
②根据溶液中亚硫酸氢根离子浓度和亚硫酸根离子浓度的相对大小确定溶液的酸碱性;
③阳极上阴离子失电子发生氧化反应;
(2)利用盖斯定律计算反应热;
(3)根据反应前和反应后一氧化碳和水之间的体积比结合反应方程式计算出平衡时各种物质的物质的量浓度,再根据平衡常数公式进行计算.
解答 解:(1)①酸性氧化物和碱反应生成盐和水,所以二氧化硫和氢氧化钠反应生成亚硫酸钠和水,反应方程式为2OH-+SO2=SO32-+H2O,
故答案为:2OH-+SO2=SO32-+H2O;
②在溶液中主要以HSO3-存在,HSO3-的电离很微弱,所以n(SO32-):n(HSO3-)<1:1,根据表格知,当亚硫酸氢根离子的物质的量大于亚硫酸根离子的物质的量时,亚硫酸氢钠溶液呈酸性,亚硫酸氢根离子既能水解又能电离,亚硫酸氢钠溶液呈酸性同时说明HSO3-的电离程度大于水解程度,
故答案为:酸性;HSO3-存在HSO3-?H++SO32- 和HSO3-+H2O?H2SO3+OH-,HSO3-的电离程度大于水解程度;
③阳极上亚硫酸氢根离子失电子和水反应生成硫酸根离子和氢离子,电极反应式为:HSO3-+H2O-2e-=SO42-+3H+,
故答案为:HSO3-+H2O-2e-=SO42-+3H+;
(2)已知:①CH4(g)+4NO2(g)=4NO(g)+CO2(g)+2H2O(g);△H=-574kJ/mol
②CH4(g)+4NO(g)=2N2(g)+CO2(g)+2H2O(g);△H=-1160kJ/mol
利用盖斯定律将$\frac{①+②}{2}$得CH4(g)+2NO2(g)=N2(g)+CO2(g)+2H2O(g);△H=-867kJ/mol
n(CH4)=$\frac{4.48L}{22.4L/mol}$,整个过程中转移的电子总数为:0.20mol×8NA=1.60NA,放出的热量为:0.2mol×867kJ/mol=173.4kJ,
故答案为:1.60NA(或1.6NA);173.4;
(3)同一容器中各气体的物质的量之比等于其体积之比,
设容器的体积为1L,加入的一氧化碳的物质的量为1mol,则水的物质的量为2mol,假设平衡时一氧化碳的物质的量为x,
CO(g)+H2O(g)?CO2(g)+H2(g)△H<0
开始 1mol 2mol 0 0
反应 1-x 2-6x 1-x 1-x
平衡 x 6x 1-x 1-x
则:(1-x):(2-6x)=1:1,x=0.2mol,
所以平衡时,c(CO)=0.2mol/L,c(H2O)=1.2mol/L,c(H2)=C(CO2)=0.8mol/L,
K=$\frac{0.8×0.8}{0.2×1.2}$=$\frac{8}{3}$≈2.67,
故答案为:2.67.
点评 本题考查较为综合,涉及离子方程式、电极反应式的书写和化学平衡常数的计算等知识点,明确同一体系中气体的物质的量之比等于其体积之比是解(3)题的关键,注意电极反应式的书写是高考热点,难度中等.


科目:高中化学 来源: 题型:解答题
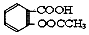 )是世界上应用最广泛的解热、镇痛和抗炎药.乙酰水杨酸受热易分解,分解温度为128-135℃.某学习小组在实验室以水杨酸(邻羟基苯甲酸)与醋酸酐[(CH3CO)2O]为主要原料合成阿司匹林,反应原理如图:
)是世界上应用最广泛的解热、镇痛和抗炎药.乙酰水杨酸受热易分解,分解温度为128-135℃.某学习小组在实验室以水杨酸(邻羟基苯甲酸)与醋酸酐[(CH3CO)2O]为主要原料合成阿司匹林,反应原理如图: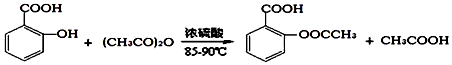
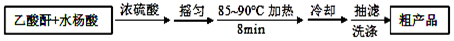
| 名 称 | 相对分子质量 | 熔点或沸点(℃) | 水 |
| 水杨酸 | 138 | 158(熔点) | 微溶 |
| 醋酸酐 | 102 | 139.4(沸点) | 易水解 |
| 乙酰水杨酸 | 180 | 135(熔点) | 微溶 |
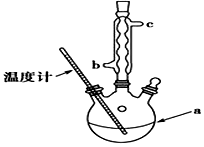
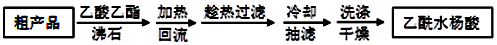
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 1mol Cl2参加反应转移电子数一定为2NA | |
| B. | 1mol NaHCO3晶体中阳离子数为2NA | |
| C. | 常温常压条件下,14g乙烯和丁烯混合物含有的共用电子对数为3NA | |
| D. | 1ml•L-1 NaCl溶液中含有的Na+数为NA |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 第一电离能:③>②>① | B. | 原子半径:③>②>① | ||
| C. | 电负性:③>①>② | D. | 最高化合价:②>①>③ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 常温常压下,氯气的摩尔质量等于71g | |
| B. | 1molH2SO4中含有2mol氢元素 | |
| C. | 某物质的摩尔质量就是该物质的相对分子质量或相对原子质量 | |
| D. | 2g氦气所含的原子数目约为0.5×6.02×1023 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 标准状况下,22.4LCCl4含有的分子数约为6.02×1023个 | |
| B. | 1L氢气一定比1L氧气质量少 | |
| C. | 含有6.02×1023个Fe3+的Fe2(SO4)3中SO42-的物质的量为3mol | |
| D. | 1molAl3+带有的正电荷数为3NA |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A | B | C | D |
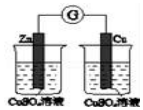 | 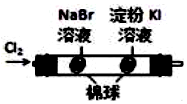 | 将稀盐酸与碳酸钠 溶液混合 | 5%的H2O2溶 液中滴入2滴 1molL-1氯化 铁溶液 |
| 验证化学能 转化为电能 | 验证氧化性Cl2>Br2>I2 | 验证氯比氮的非金属性强 | 验证催化剂加快 反应速率 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
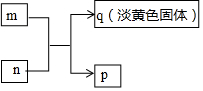 X、Y、Z、W是原子序数依次增大的短周期主族元素,其中Y、W同主族,W的最外层电子数为Z的2倍,m、n分别是X、Y与W形成的化合物,m、n有如图所示的转化关系,p为常见的液态化合物,q是W的单质.下列说法不正确的是( )
X、Y、Z、W是原子序数依次增大的短周期主族元素,其中Y、W同主族,W的最外层电子数为Z的2倍,m、n分别是X、Y与W形成的化合物,m、n有如图所示的转化关系,p为常见的液态化合物,q是W的单质.下列说法不正确的是( )| A. | 原子半径:Z>W>Y>X | |
| B. | 简单氢化物的稳定性:Y>W | |
| C. | m、n、p均为只含极性键的共价化合物 | |
| D. | Z、W形成的化合物可由两种盐溶液通过复分解反应制得 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com