
有①Na2CO3溶液 ②CH3COONa溶液 ③NaOH溶液各25 mL,物质的量浓度均为0.1 mol·L-1,下列说法正确的是( )
A.3种溶液pH的大小顺序是③>②>①
B.若将3种溶液稀释相同倍数,pH变化最大的是②
C.若分别加入25 mL 0.1 mol·L-1的盐酸后,pH最大的是①
D.若3种溶液的pH均为9,则物质的量浓度的大小顺序是③>①>②
科目:高中化学 来源: 题型:
下列事实不能用化学平衡移动原理解释的是( )
A.溴水中有下列平衡Br2+H2O HBr+HBrO,当加入硝酸银溶液后,溶液颜色变浅
HBr+HBrO,当加入硝酸银溶液后,溶液颜色变浅
B.合成氨反应为提高氨的产率,理论上应采取降低温度的措施
C.反应CO(g)+NO2(g) CO2(g)+NO(g)(正反应为放热反应),达平衡后,升高温度体系颜色变深
CO2(g)+NO(g)(正反应为放热反应),达平衡后,升高温度体系颜色变深
D.对于2HI(g) H2(g)+I2(g),达平衡后缩小容器体积可使体系颜色变深
H2(g)+I2(g),达平衡后缩小容器体积可使体系颜色变深
查看答案和解析>>
科目:高中化学 来源: 题型:
光气(COCl2)在塑料、制革、制药 等工业中有许多用途,工业上采用高温下CO与Cl2在活性炭催化下合成。
等工业中有许多用途,工业上采用高温下CO与Cl2在活性炭催化下合成。
(1)实验室中常用来制备氯气的化学方程式为____________________________;
(2)工业上利用天然气(主要成分为CH4)与CO2进行高温重整制备CO,已知CH4、H2和CO的燃烧热(ΔH)分别为-890.3 kJ·mol-1、-285.8 kJ·mol-1和
-283.0 kJ·mol-1,则生成1 m3(标准状况)CO所需热量为______________;
(3)COCl2的分解反应为COCl2(g)====Cl2(g)+CO(g) ΔH=+108 kJ·mol-1。反应体系达到平衡后,各物质的浓度在不同条件下的变化状况如图所示(第10 min到14 min的COCl2浓度变化曲线未表示出):
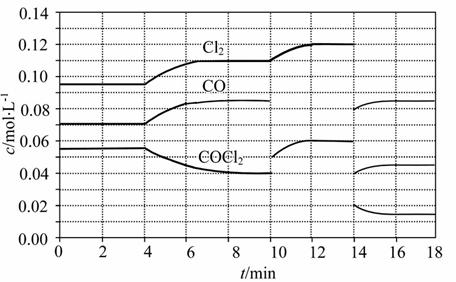
①计算反应在第8 min时的平衡常数K=__________;
②比较第2 min反应温度T(2)与第8 min反应温度T(8)的高低:T(2)_____
T(8)(填“<”“>”或“=”);
③若12 min时反应于温度T(8)下重新达到平衡,则此时c(COCl2)=________
___ mol·L-1;
④比较反应物COCl2在5 min~6 min和15 min~16 min时平均反应速率的大小:v(5~6)_____v(15~16)(填“<”“>”或“=”),原因是______________
_________________________________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
下列离子方程式中正确的是( )
A.澄清的石灰水与稀盐酸反应:Ca(OH)2+2H+====Ca2++2H2O
B.钠与水的反应:Na+2H2O====Na++2OH-+H2↑
C.铜片插入硝酸银溶液中:Cu+Ag+====Cu2++Ag
D.大理石溶于醋酸的反应:CaCO3+2CH3COOH====Ca2++2CH3COO-+CO2↑+H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
已知一种[H+]=1×10-3 mol·L-1的某酸与一种[OH-]=1×10-3 mol·L-1的某碱等体积混合后溶液呈酸性,其原因可能是( )
A.稀的强碱与浓的强酸反应
B.等物质的量浓度的一元强酸和一元弱碱反应
C.浓的弱酸与稀的强碱溶液反应
D.生成一种强酸弱碱盐
查看答案和解析>>
科目:高中化学 来源: 题型:
短周期元素X、Y、Z、W在元素周期表中的相对位置如图所示,其中W原子的最外层电子数是最内层电子数的3倍。下列判断正确的是
( )
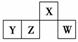
A.原子半径:rW>rZ>rY>rX
B.含Y元素的盐溶液有的显酸性,有的显碱性
C.气态氢化物的热稳定性:Z>W
D.X与H、O元素形成的化合物一定是共价化合物
查看答案和解析>>
科目:高中化学 来源: 题型:
碘与氢气反应的热化学方程式如下:
①I2(g)+H2(g)2HI(g) ΔH=-9.48 kJ·mol-1
②I2(s)+H2(g)2HI(g) ΔH=+26.48 kJ·mol-1
下列判断正确的是( )
A.254 g I2(g)中通入2 g H2(g),反应放热9.48 kJ
B.1 mol固态碘与1 mol气态碘所含的能量相差17.00 kJ
C.反应①的产物比反应②的产物稳定
D.反应②的反应物总能量比反应①的反应物总能量低
查看答案和解析>>
科目:高中化学 来源: 题型:
某溶液中有Fe3+、Mg2+、Fe2+和Na+四种离子,向其中加入过量的氢氧化钠溶液并搅拌,再加入过量盐酸,溶液中大量减少的阳离子是( )
|
| A. | Fe3+ | B. | Mg2+ | C. | Fe2+ | D. | Na+ |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com