
| A. | 为除去酸性CuCl2溶液中含有的少量Fe3+,可在加热、搅拌的条件下加入氨水,过滤后,再向滤液中加入适量盐酸 | |
| B. | 在工业合成NH3的反应中,采取高温措施 | |
| C. | 恒温下,对平衡体系H2(g)+Br2(g)?2HBr(g)加压,可使气体颜色变深 | |
| D. | 向饱和氯化钠溶液中不断缓慢地通入HCl气体,会析出晶体 |
分析 勒夏特利原理是如果改变影响平衡的一个条件(如浓度、压强或温度等),平衡就向能够减弱这种改变的方向移动,勒夏特利原理适用的对象应存在可逆过程,如与可逆过程的平衡移动无关、与平衡移动无关,则不能用勒夏特利原理解释.
解答 解:A、Fe3+易水解生成氢氧化铁沉淀,所加入氨水起到调节溶液pH的作用,促进铁离子的水解,所以能用勒夏特列原理解释,故A正确;
B、合成氨反应为放热反应,升高温度不利用平衡向正方向移动,但升温却可提高反应速率,与勒沙特列原理不符,故B错误;
C、对平衡体系H2(g)+Br2(g)?2HBr(g)加压,平衡不移动,但各组分的浓度变大,溴蒸颜色变深,与勒沙特列原理不符,故C错误;
D、向饱和氯化钠溶液中不断缓慢地通入HCl气体,氯化氢易溶于水,浓的氯化氢易挥发,使溶剂减少,导致晶体析出,与勒沙特列原理不符,故D错误;
故选A.
点评 本题考查勒夏特列原理知识,题目难度不大,注意使用勒夏特列原理的前提必须是可逆反应,且是否发生平衡的移动.


 新题型全程检测期末冲刺100分系列答案
新题型全程检测期末冲刺100分系列答案科目:高中化学 来源: 题型:实验题
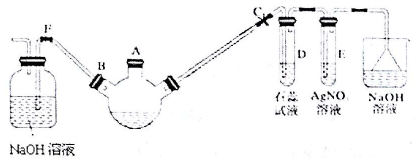
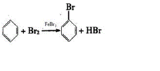 .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
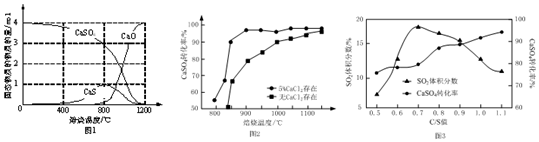
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
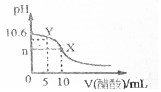 已知常温下CH3COOH和NH3•H2O的电离常数相等,现向10mL浓度为0.01mol•L-1的氨水溶液中滴加相同浓度的CH3COOH溶液,在滴加过程中溶液的pH与所加醋酸的体积关系如图所示.已知100.4=2.5.下列说法错误的是( )
已知常温下CH3COOH和NH3•H2O的电离常数相等,现向10mL浓度为0.01mol•L-1的氨水溶液中滴加相同浓度的CH3COOH溶液,在滴加过程中溶液的pH与所加醋酸的体积关系如图所示.已知100.4=2.5.下列说法错误的是( )| A. | n=7 | |
| B. | 水的电离程度先增大再减小 | |
| C. | 常温下醋酸的电离常数约是1.67×10-5 | |
| D. | Y点溶液中c(NH3•H2O)+c(OH-)=c(CH3COO-)+c(H+) |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 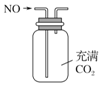 用图所示装置(正放)可收集NO气体 | |
| B. | 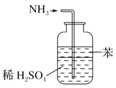 用图所示装置可吸收多余氨气且能防止倒吸 | |
| C. | 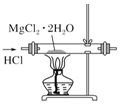 用装置制取无水MgCl2 | |
| D. | 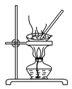 用装置蒸干NH4Cl饱和溶液获取NH4Cl晶体 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com