
【题目】某烃A的相对分子质量为84。回答下列问题:
(1)下列物质与A以任意比例混合,若总物质的量一定,充分燃烧消耗氧气的量不相等的是(填序号)_______。
A.C7H12O2 B.C6H14 C.C6H14O D.C7H14O3
(2)若烃A为链烃,与HBr加成后只能得到一种产物,且该烃的一氯代物只有一种。
①A的结构简式为______________;名称是______________________。
②A在一定条件下能发生加聚反应,写出该反应的化学方程式_____________________。
(3)若核磁共振氢谱显示链烃A中有三个峰,且峰面积比为3:2:1,写出A所有可能的结构简式____。
【答案】B 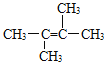 2,3-二甲基-2丁烯 n
2,3-二甲基-2丁烯 n
![]()
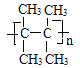 CH3-CH2-CH=CH-CH2-CH3、CH2=C(CH2CH3)2
CH3-CH2-CH=CH-CH2-CH3、CH2=C(CH2CH3)2
【解析】
(1)先用商余法确定A的分子式,然后看1molA消耗的O2的物质的量,将烃及烃的含氧衍生物通式可知CxHyOz,若总物质的量一定,若各组分耗氧量(x+![]() )相等,则消耗氧气的量相等,否则不相等,对各个选项注意分析判断;
)相等,则消耗氧气的量相等,否则不相等,对各个选项注意分析判断;
(2)若烃A为链烃,应含有一个碳碳双键,与HBr加成后只能得到一种产物,且该烃的一氯代物只有一种说明分子结构对称,该分子的一氯取代物只有一种,说明A分子中只有一种H原子;
(3)若核磁共振氢谱显示链烃A有三组不同的峰,峰面积比为3:2:1,说明分子中含有3种不同位置的H原子,结合分子中H原子数目确定分子结构;
某烃A的相对分子质量为84,则烃中C原子最大数目=84÷12=7,故有机物分子式为C6H12。
(1)1mol C6H12的耗氧量=(6+3)mol=9mol,若各组分耗氧量(x+![]() )相等,则消耗氧气的量相等,否则不相等。
)相等,则消耗氧气的量相等,否则不相等。
A.1molC7H12O2的耗氧量=(7+3-1)mol=9mol;
B.1molC6H14的耗氧量=(6+![]() )mol=9.5mol;
)mol=9.5mol;
C.1molC6H14O的耗氧量=(6+![]() )mol=9mol;
)mol=9mol;
D.1molC7H14O3的耗氧量=(7+![]() )mol=9mol;
)mol=9mol;
可见等物质的量的C6H12与C6H14的耗氧量不相等,故合理选项是B;
(2)若烃A为链烃,应含有一个碳碳双键,与HBr加成后只能得到一种产物,且该烃的一氯代物只有一种说明分子结构对称,该分子的一氯取代物只有一种,说明A分子中只有一种H原子,符合题意的A结构简式为 ,该物质的名称为2,3-二甲基-2丁烯;
,该物质的名称为2,3-二甲基-2丁烯;
该分子中含有碳碳双键,在一定条件下发生加聚反应,反应方程式为:
n
![]()
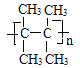 ;
;
(3)若核磁共振氢谱显示链烃A有三组不同的峰,峰面积比为3:2:1,说明分子中含有3种不同位置的H原子,结合分子中H原子数目确定分子结构;则H原子数目分别为6、4、2,则A为CH3-CH2-CH=CH-CH2-CH3,也可能为CH2=C(CH2CH3)2。


科目:高中化学 来源: 题型:
【题目】用NA代表阿伏加德罗常数的数值,下列说法正确的是( )
A.NA个臭氧分子(O3)与NA个二氧化碳分子质量相等
B.常温常压下,2.24L氮气含有的氮原子数大于0.2NA
C.2.3g金属钠与足量氧气完全反应,转移电子数为0.1NA
D.100mL0.5mol·L﹣1硫酸溶液中含有0.05NA个H2SO4分子
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】Ⅰ.如图1所示是中学化学中常用于混合物的分离和提纯的装置,请根据装置回答问题:
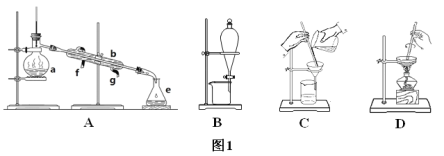
(1)从氯化钾溶液中得到氯化钾固体选择装置___(填代表装置图的字母,下同);除去自来水中的氯离子等杂质选择装置____。
(2)从碘水中分离出I2选择装置_____,该分离方法的名称为____。
(3)装置A中仪器a的名称是_____,进水的方向是____。
Ⅱ.海水中蕴藏着丰富的资源,在实验室中取少量海水,进行如图2流程的实验:

(1)粗盐中含Ca2+、Mg2+、SO42-等杂质,需要提纯后才能综合利用。粗盐提纯的步骤有: ①加入过量的Na2CO3溶液②加入过量的BaCl2溶液;③加入过量的NaOH溶液;④加入盐酸调节溶液至中性;⑤溶解;⑥过滤;⑦蒸发。正确的操作顺序是(填写序号字母)______。
a.⑤②③①④⑥⑦ b.⑤①②③⑥④⑦ c.⑤②①③④⑥⑦ d.⑤③②①⑥④⑦
(2)由海水到氯化钠晶体的实验过程中要用到的主要装置是(从图1中给定的四种装置中选择)____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】分类是科学研究的重要方法,下列物质分类正确的是( )
A. 非电解质:乙醇、氯气B. 酸性氧化物:NO、![]()
C. 胶体:豆浆、葡萄糖溶液D. 离子化合物:NaH、![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用NA表示阿伏伽德罗常数的值,下列叙述中正确的是
A.含有NA个N的N2在标准状况下的体积约为22.4L
B.在常温常压下,11.2LCO2含有的分子数为0.5NA
C.标准状况下,11.2L氟化氢(沸点为19.54℃)中含有氟原子的数目为0.5 NA
D.3.2gO2和O3的混合物,所含氧原子数为0.2NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有机物M、N、Q的转化关系如下图所示,下列说法正确的是( )

A. M的名称为异丁烷
B. N的同分异构体有7种(不考虑立体异构,不包括本身)
C. Q的所有碳原子一定共面
D. Q能使溴的四氯化碳溶液和酸性KMnO4溶液褪色,褪色原理相同
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】碘是人体不可缺乏的元素,为了防止碘缺乏,一般是在食盐中添加一定量的KIO3。但碘添加量也不能过多,过多会导致甲亢等。国家标准GB14880-1994中规定每千克食盐中碘的含量(以碘原子计)应为20-60mg/kg。实验研究小组为了检测某加碘盐中碘含量是否合格,查阅了有关的资料,发现其检测原理是:![]() (方程式未配平)。试根据相关信息回答下列问题:
(方程式未配平)。试根据相关信息回答下列问题:
(1)检测原理中,氧化剂为_______,氧化产物为_______。请在下面配平该方程式,同时用单线桥标明电子转移的方向和数目:_______
____![]() ____
____ ![]() ____
____![]() —____
—____![]() + ____
+ ____ ![]() +____
+____ ![]()
(2)取10g加碘盐加蒸馏水溶解,然后加入稀硫酸和KI溶液(H2SO4和KI都稍过量),充分反应后,将反应液转入分液漏斗中,再加入一定量的CCl4,振荡,静置,此时观察到的现象是________________________________________________。然后分液,即得到I2的CCl4溶液。
(3)查阅资料,CCl4的沸点为78℃,I2的升华温度约为120~130℃。实验小组拟采用下图所示实验装置将CCl4和I2的混合溶液分离。该分离方法的名称是___________,冷凝管的进水口是_______(填“a”或“b”)。
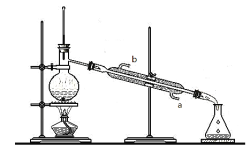
(4)上述实验结束,用电子天平称量出圆底烧瓶中I2的质量为1.5 mg,由此计算出该加碘盐中碘的含量为__________mg/kg,该加碘盐_______(填“合格”或“不合格”)。
(5)KIO3虽稳定性较好,但在高温下也可分解为KI等物质,所以在使用加碘盐时最佳的添加时间是菜肴快出锅时。请书写出KIO3在锅中长时间高温爆炒时可能发生的分解反应的化学方程式____________________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用铅蓄电池电解AgNO3、Na2SO3的溶液,a、b、c、d电极材料均为石墨。已知铅蓄电池的总反应为:Pb+PbO2+2H2SO4![]() 2PbSO4+2H2O,通电时a电极质量增加,下列说法正确的是( )
2PbSO4+2H2O,通电时a电极质量增加,下列说法正确的是( )
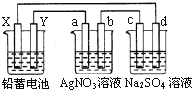
A. X极为负极
B. 放电时铅蓄电池正极的电极反应式为:PbO2+4H++SO42+4e==PbSO4+2H2O
C. c、d电极产生气体的物质的量之比为1:2
D. 电路中通过1 mol电子时,Y电极质量增加48 g
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com