
 (2)NH3
(2)NH3 2Fe2++I2
2Fe2++I2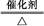 4NO+6H2O
4NO+6H2O 2Fe
2Fe +6Cl-+8H2O[或2Fe(OH3+3Cl2+10OH-
+6Cl-+8H2O[或2Fe(OH3+3Cl2+10OH- 2Fe
2Fe +6Cl-+8H2O]
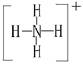
+6Cl-+8H2O]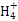 的结构式为
的结构式为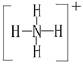 。(2)由于NH3分子间存在氢键,故NH3的沸点比HCl的高。(3)Fe3+具有氧化性,I-具有还原性,两者混合可发生反应:2Fe3++2I-
。(2)由于NH3分子间存在氢键,故NH3的沸点比HCl的高。(3)Fe3+具有氧化性,I-具有还原性,两者混合可发生反应:2Fe3++2I- 2Fe2++I2。(4)工业上制取NO是将NH3催化氧化得到,其反应为:4NH3+5O2
2Fe2++I2。(4)工业上制取NO是将NH3催化氧化得到,其反应为:4NH3+5O2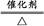 4NO+6H2O。(5)由题中信息可知反应物有Cl2、Fe3+和OH-,生成物有Fe
4NO+6H2O。(5)由题中信息可知反应物有Cl2、Fe3+和OH-,生成物有Fe ,根据氧化还原反应的规律和原子守恒可推知生成物中还有Cl-和H2O,故反应的离子方程式为:2Fe3++3Cl2+16OH-
,根据氧化还原反应的规律和原子守恒可推知生成物中还有Cl-和H2O,故反应的离子方程式为:2Fe3++3Cl2+16OH- 2Fe
2Fe +6Cl-+8H2O或2Fe(OH)3+3Cl2+10OH-
+6Cl-+8H2O或2Fe(OH)3+3Cl2+10OH- 2Fe
2Fe +6Cl-+8H2O。(6)若X为碳棒,为减缓铁的腐蚀,则K应置于N处;若X为Zn,K置于M处,构成原电池,此法称为牺牲阳极的阴极保护法。
+6Cl-+8H2O。(6)若X为碳棒,为减缓铁的腐蚀,则K应置于N处;若X为Zn,K置于M处,构成原电池,此法称为牺牲阳极的阴极保护法。

科目:高中化学 来源:不详 题型:单选题
| A.Ge的电负性为1.8,则其是典型的非金属 |
| B.L层不含s能级,M层存在3f能级 |
| C.焰火是焰色反应,都是电子由基态跃迁到激发态的结果 |
| D.在电子云示意图中,小黑点是电子在原子核外出现的概率密度的形象描述 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
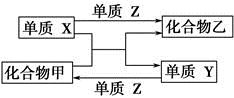
| 选项 | X | Y | Z | 甲 | 乙 |
| A | H2 | Si | Cl2 | SiCl4 | HCl |
| B | Mg | C | O2 | CO2 | MgO |
| C | Zn | Fe | Cl2 | FeCl2 | ZnCl2 |
| D | Cl2 | N2 | H2 | NH3 | HCl |
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
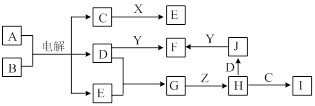
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题

查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
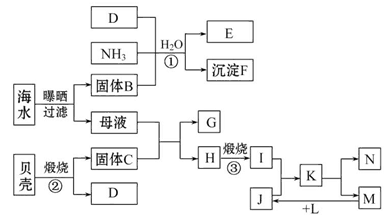
查看答案和解析>>
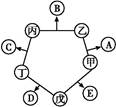
科目:高中化学 来源:不详 题型:单选题
 ,下列说法正确的是
,下列说法正确的是| A.Q一定含三种元素 | B.Q一定含有金属元素 |
| C.Q一定不是碱 | D.R与T中一定有一种盐 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.同一元素各核素的质量数不同,但它们的化学性质几乎完全相同 |
| B.任何元素的原子都是由核外电子和核内中子、质子构成的 |
| C.钠原子失去一个电子后,它的电子数与氖原子相同,变成10e-微粒 |
D.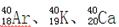 的质量数相同,所以它们互为同位素 的质量数相同,所以它们互为同位素 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com