
【题目】研究电化学腐蚀及防护的装置如图所示。下列有关说法错误的是( )

A. d为石墨,铁片腐蚀加快
B. d为石墨,石墨上电极反应为O2+2H2O+4e-=4OH-
C. d为锌块,铁片易被腐蚀
D. d为锌块,外电路中电子流向为锌块→铁片
 数学奥赛暑假天天练南京大学出版社系列答案
数学奥赛暑假天天练南京大学出版社系列答案 南大教辅抢先起跑暑假衔接教程南京大学出版社系列答案
南大教辅抢先起跑暑假衔接教程南京大学出版社系列答案科目:高中化学 来源: 题型:
【题目】原子序数由小到大排列的四种短周期元素 X、Y、Z、W,其中 X、Z、W 与氢元 素可组成 XH3、H2Z 和 HW 共价化合物;Y 与氧元素可组成 Y2O 和 Y2O2 离子化合物。
(1)写出 Y2O2 的电子式:______________,其中含有的化学键是______________。
(2)Z 元素在周期表中的位置是______________。X 和 Z 形成的一种二元化合物具有温室效应,其相 对分子质量在 170~190 之间,且 Z 的质量分数约为 70%。该化合物的化学式为______________ 。
(3)XH3、H2Z 和 HW 三种化合物,其中一种与另外两种都能反应的是_________________ (填化学式)。
(4)由 X、W 组成的化合物分子中,X、W 原子的最外层均达到 8 电子稳定结构,该化合物遇水可生成一种具有漂白性的化合物,试写出反应的化学方程式_________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图是部分短周期元素(用字母x等表示)化合价与原子序数的关系图。

根据判断出的元素回答问题:
(1)h在周期表中的位置是__________。
(2)比较z、f、g、r常见离子的半径大小(用化学式表示,下同):______>______>______>______;比较r、m的最高价氧化物对应水化物的酸性强弱:______>______>;比较d、m的氢化物的沸点:______>______。
(3)x与氢元素能形成多种化合物,其中既含极性键又含非极性键,且相对分子质量最小的物质是(写分子式)______,实验室制取该物质的化学方程式为:____________________________________。
(4)由y、m和氢元素组成一种离子化合物,写出其电子式:___________________________。
(5)用铅蓄电池作电源,惰性电极电解饱和em溶液,则电解反应的生成物为(写化学式)___________________________。铅蓄电池放电时正极反应式为式)___________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某温度下,在一个2L的密闭容器中,X、Y、Z三种物质的物质的量随时间的变化曲线如图所示。根据图中数据,填写下列空白:
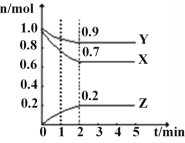
(1)从开始至2min,X的平均反应速率为__。
(2)该反应的化学方程式为___。
(3)1min时,v(正)__v(逆),2min时,v(正)__v(逆)。(填“>”或“<”或“=”)。
(4)上述反应在甲、乙两个相同容器内同时进行,分别测得甲中v(X)=9mol·L-1·min-1,乙中v(Y)=0.5mol·L-1·s-1,则___中反应更快。
(5)若X、Y、Z均为气体,在2min时,向容器中通入氩气(容器体积不变),X的化学反应速率将___,若加入适合的催化剂,Y的化学反应速率将___。(填“变大”或“不变”或“变小”)。
(6)若X、Y、Z均为气体(容器体积不变),下列能说明反应已达平衡的是___。
a.X、Y、Z三种气体的浓度相等
b.气体混合物物质的量不再改变
c.反应已经停止
d.反应速率v(X)︰v(Y)=3︰1
e.(单位时间内消耗X的物质的量):(单位时间内消耗Z的物质的量)=3︰2
f.混合气体的密度不随时间变化
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】根据原电池原理和电解原理进行如图回答。
请回答:
I 请根据图作答

(1)如图氢氧燃料电池的能量转化主要形式是________,在导线中电子流动方向用a___b(用“→”或“←”表示)。
(2)正极反应式为___________________________。
II 用如图所示装置进行实验(K闭合).

(3)Zn极为________极;实验过程中,SO42-________(填“从左向右”、“从右向左”或“不”)移动。
(4)y极的电极反应现象为________;Cu极的电极反应式为____________________。
(5)若想通过上图实现在铁上镀铜,则应该将y电极换成______(填铁或铜),AlCl3溶液换成___________溶液。
III(6)有人设想寻求合适的催化剂和电极材料,以N2、H2为电极反应物,以HClNH4Cl为电解质溶液制取新型燃料电池,请写出该电池的正极反应式______________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】钠及其化合物在生产和生活中有广泛的应用。
(1)钠长时间放在空气中,最后产物的主要成分是_____________(填化学式),保存金属钠的方法是___________________。
(2)某实验小组利用下图装置探究Na2O2与CO2的反应,请回答下列问题:

①根据实验目的,B处所盛放的试剂为__________,其作用为______________。
②装置C中观察到的现象是_________,反应的化学方程式是___________。
③装置D的作用是吸收未反应的CO2便于O2的检验,吸收CO2的离子方程式是___。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知下列事实不能用勒夏特列原理解释的是()
A.光照新制的氯水时,溶液的 pH 逐渐减小
B.氨水应密闭保存于低温处
C.打开汽水瓶时,有大量气泡逸出
D.高温高压有利于N2和H2转化为 NH3::N2(g)+3H2(g)![]() 2NH3(g) △H<0
2NH3(g) △H<0
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】A、B、C、D、E、F 是六种短周期元素,它们的原子序数依次增大;A 元素的原子是半径最小的原子;B 元素的最高价氧化物对应水化物与其气态氢化物反应生成一种盐 X;D 与 A 同主族,且与 F 同周期;F 元素的最外层电子数是其次外层电子数的 3/4 倍,A、B、D、F 这四种元素,每一种与 C 元素都能形成元素的原子个数比不相同的若干种化合物.D、E、F 三种元素对应的最高价氧化物的水化物间两两皆能反应.请回答下列问题:
(1)写出 C 元素的名称 C_____
(2)写出 C、D 两种元素形成的原子个数比为 1:1 的物质的电子式为_____.
(3)可以验证 C 和 F 两种元素非金属性强弱的结论是(填编号)_____;
①比较这两种元素常见单质的熔点
②比较这两种元素的单质与氢气化合的难易程度
③比较这两种元素的气态氢化物的还原性
(4)A、C、D、F 四种元素可以形成两种酸式盐(均由四种元素组成),这两种酸式盐的化学式分别为_____、_____,这两种酸式盐相互反应的离子方程式为_____.
(5)A、C、F 间可形成甲、乙两种微粒,它们均为负一价双原子阴离子,且甲有18个电子,乙有10个电子,则甲与乙反应的离子方程式为_____.
(6)向含有a mol E 的氯化物的溶液中加入含b mol D 的最高价氧化物对应水化物的溶液,生成沉淀的物质的量不可能为_____.
①a mol ②b mol ③ a/3mol ④ b/3mol ⑤0 ⑥(4a b)mol.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】次氯酸钠稳定性远髙于次氯酸钠,也可用于杀菌消毒。制备次氯酸钠方法较多,常用的一种合成路线如下:

已知:1.次氯酸叔丁酯((CH3)3COCl),相对分子质量为108.5,是具有挥发性的黄色油状液体,密度为0.802g/mL,且有强烈刺激性臭味;2.(CH3)3COCl+LiOH=LiClO+(CH3)3COH
请回答:
(1)实验第一步的反应装置如图所示(夹持装置省略),B装置中支管的作用是___________;浓盐酸逐滴滴加而不是一次性加入的原因是_______________。

(2)请写出在装置A中发生反应的化学方程式___________________。
(3)对于操作1,下列说法不正确的是__________。
A.可以选用250mL规格的分液漏斗
B.操作1须在通风橱内进行
C.进行分液时,可提早关闭旋塞,以防止次氯酸叔丁酯从下口流出
D.装置B不合适进行操作1
(4)进行操作3时,并不是直接加热蒸发溶液,而是选择在40°C下缓慢蒸发溶液,试解释其原因 __________。
(5)该实验中次氯酸锂的产率为_____________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com