


科目:高中化学 来源: 题型:
| A、X、Y、Z、W的原子半径的大小关系为:W>Y>Z>X |
| B、在化合物Y2X2、Z2X4、X2W2中,分子所含的共用电子对数相等 |
| C、与元素Y、Z相比,元素W形成的简单氢化物最稳定,是因为其分子间存在氢键 |
| D、X、Y、Z、W四种元素可形成化学式为X7Y2ZW2的化合物 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、体积 ④<①<②<③ |
| B、密度 ①<④<③<② |
| C、质量 ④<①<③<② |
| D、氢原子数 ②<④<③<① |
查看答案和解析>>
科目:高中化学 来源: 题型:
 海底热液研究处于当今科研的前沿,海底热液活动区域“黑烟囱”的 周围存在FeS、黄铜矿及锌矿等矿物.
海底热液研究处于当今科研的前沿,海底热液活动区域“黑烟囱”的 周围存在FeS、黄铜矿及锌矿等矿物.查看答案和解析>>
科目:高中化学 来源: 题型:
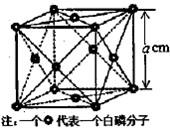 氮族元素包括N、P、As、Sb和Bi五种元素.
氮族元素包括N、P、As、Sb和Bi五种元素.查看答案和解析>>
科目:高中化学 来源: 题型:
 磁性材料氮化铁镍合金可用Fe(NO3)3、Ni(NO3)2、丁二酮肟、氨气、氮气、氢氧化钠、盐酸等物质在一定条件下反应制得.
磁性材料氮化铁镍合金可用Fe(NO3)3、Ni(NO3)2、丁二酮肟、氨气、氮气、氢氧化钠、盐酸等物质在一定条件下反应制得.查看答案和解析>>
科目:高中化学 来源: 题型:
| A、常温下pH为5的盐酸溶液稀释1000倍后,pH等于8 |
| B、碳酸钠溶液中存在:c(Na+)+c(H+)=c(CO32-)+c(OH-)+c(HCO3-) |
| C、浓度均为0.1mol/L的氨水和氯化铵溶液,水电离出的c(H+)前者小于后者 |
| D、等浓度的CH3COOH与KOH以任意比混合:c(K+)+c(H+)=c(OH-)+c(CH3COO-) |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com