
分析 Fe元素基态原子核外电子排布式为1s22s22p63s23p63d64s2,可知在3d上存在4个未成对电子,先失去4s上的2个电子后、再失去3d上的1个电子形成Fe3+,硫氰化铁为血红色;
解答 解:Fe元素基态原子核外电子排布式为1s22s22p63s23p63d64s2,可知在3d上存在4个未成对电子,先失去4s上的2个电子后、再失去3d上的1个电子形成Fe3+,Fe3+的电子排布式为1s22s22p63s23p63d5,硫氰化铁为血红色,
故答案为:4;1s22s22p63s23p63d5;血红色.
点评 本题是对物质结构与性质的考查,涉及核外电子排布、配合物等,难度不大,注意对基础知识的理解掌握.


科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 反应中氧化剂和还原剂的质量比为1:2 | |
| B. | 反应中生成了8g Cu2S | |
| C. | 反应中有0.2×6.02×1023个电子转移 | |
| D. | 反应中有1.6g硫被氧化 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 常温常压下,11.2 LCO2所含的原子数为1.5NA | |
| B. | 标准状况下,22.4 L CCl4中所含分子数为NA | |
| C. | 标准状况下,18g水所含原子数为NA | |
| D. | 常温常压下,48 g O2与O3混合物含有的氧原子数为3NA |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
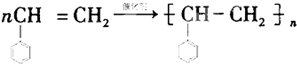 .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
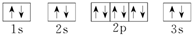 ;D
;D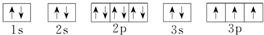 .
.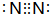 ,氢化物
,氢化物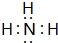 .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
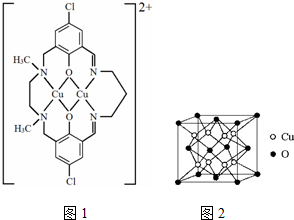
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 乙元素的族序数比甲元素的族序数大 | |
| B. | 甲、丙元素最高价氧化物对应水化物的酸性强弱顺序为:甲<丙 | |
| C. | 原子半径由大到小的顺序为:丙>甲>乙 | |
| D. | 含乙元素的化合物数目比含甲或丙元素的化合物数目多 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | “两水”都是混合物,溶液中含有的粒子种类、数目相同 | |
| B. | “两水”中存在相同弱电解质的电离 | |
| C. | “两水”都有刺激性气味,都能漂白有机色素 | |
| D. | “两水”放置时间较久后,都会因为相同的原理而变质 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com