
对下列实验的描述正确的是( )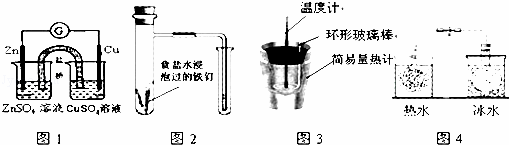
|
| A. | 图1所示的实验:根据电流计(G)中指针是否偏转即可比较Zn、Cu的金属活泼性 |
|
| B. | 图2所示的实验:根据小试管中液面的变化判断铁钉发生析氢腐蚀 |
|
| C. | 图3所示的实验:根据温度计读数的变化测定稀硫酸和NaOH溶液反应的反应热 |
|
| D. | 图4所示的实验:根据两烧瓶中气体颜色的变化(热水中变深、冰水中变浅)判断2NO2(g)⇌N2O4(g)是吸热反应 |
| 金属的电化学腐蚀与防护;化学平衡的影响因素;中和热的测定.. | |
| 专题: | 化学反应中的能量变化;化学平衡专题;电化学专题. |
| 分析: | A.Cu、Zn原电池中,活泼金属为负极,根据原电池的工作原理来回答; B.析氢腐蚀生成氢气,而吸氧腐蚀中氧气得电子,气体减少; C.中和热测定应选稀的强酸和稀的强碱之间反应; D.热水中颜色深,则逆反应为吸热反应. |
| 解答: | 解:A.Cu、Zn原电池中,活泼金属为负极,则根据检流计(G)中指针偏转的方向可比较Zn、Cu的金属活泼性,根据指针偏转只能判断是否有电流产生,故A错误; B.析氢腐蚀生成氢气,而吸氧腐蚀中氧气得电子,气体减少,则根据试管中液面的升降可判断铁钉发生的是析氢腐蚀还是吸氧腐蚀,故B正确; C.中和热测定应选稀的强酸和稀的强碱之间来反应,故C正确; D.热水中颜色深,则逆反应为吸热反应,所以正反应为放热反应,故D错误; 故选BC. |
| 点评: | 本题考查较综合,涉及原电池和电解原理、中和热测定、温度对化学平衡的影响等,注意选项C为解答的易错点,题目难度中等. |


科目:高中化学 来源: 题型:
短周期元素A、B、C、D、E,原子序数依次增大。已知元素A的气态氢化物和A的最高价氧化物对应的水化物反应生成盐;B、E为同主族元素,B元素原子最外层电子数是次外层的3倍;D是地壳中含量最多的金属元素;C是短周期中与水反应最激烈的金属元素。下列叙述不正确的是
A.元素A的氧化物常温下一般均为无色无味气体
B.元素C、D、E的最高价氧化物对应的水化物两两之间能发生反应
C.原子半径:C>D>B
D.元素B的气态氢化物的沸点比元素E气态氢化物的沸点高
查看答案和解析>>
科目:高中化学 来源: 题型:
下列反应所得的溶液中一定只含一种溶质的是( )
|
| A. | 向硫酸酸化的Fe2(SO4)3溶液中加入过量的Ba(OH)2溶液 |
|
| B. | 向AlCl3溶液中加入过量的氨水 |
|
| C. | 向NaOH溶液中通人CO2气体 |
|
| D. | 将过量的Cu粉加入FeCl3溶液 |
查看答案和解析>>
科目:高中化学 来源: 题型:
随着能源与环境问题越来越被人们关注,碳一化学成为研究的热点.“碳一化学”即以单质碳及CO、CO2、CH4、CH3OH等含一个碳原子的物质为原料合成工业产品的化学与工艺.
Ⅰ、热化学方程式为:CO2(g)+3H2(g)⇌CH3OH(g)+H2O(g)△H=﹣49.0kJ/mol,在温度和容积相同的A、B、C三个容器中(容器的体积为2L),按不同方式投入反应物,保持恒温恒容,经10秒钟后达到平衡,达到平衡时的有关数据如下表:
| 容器 | A | B | C |
| 反应物投入量 | 1molCO2(g)和 3molH2(g) | 1molCH3OH(g)和 1molH2O(g) | 2molCO2(g)和6mol H2(g) |
| CH3OH(g)浓度(mol/L) | c1 | c2 | c3 |
| 反应能量变化 | 放出29.4kJ | 吸收a kJ | 放出b kJ |
①从反应开始到达平衡时,A中用CO2来表示的平均反应速率为 0.03 mol/(L•s)(用具体数值表示)
②a= 19.6 .c1 = c2 < 1/2c3(填“>”“<”或“=”).
Ⅱ、CO可用于合成甲醇.在压强0.1MPa条件下,向体积为bL的密闭容器中充入amolCO和2amolH2,在催化剂作用下合成甲醇:CO(g)+2H2(g)⇌CH3OH(g).平衡时CO的转化率与温度、压强的关系如图1所示

(1)该反应属于反应 放热 (填“吸热”或“放热”);P2 > 0.1MPa(填“>”“<”或“=”)
(2)100℃时,该反应的平衡常数K= 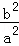 (用含a、b的代数式表示)
(用含a、b的代数式表示)
Ⅲ、碳一化合物在治理汽车尾气方面也大有可为,如CO、CH4等在一定条件下均可以与氮氧化物生成无污染的物质.CO与NO在催化剂的条件下反应如下:2NO(g)+2CO(g)⇌2CO2(g)+N2(g)△H<0,在绝热、恒容的密闭容器中加入一定量的NO和CO发生上述反应,图2的示意图不能说明反应在进行到t1时刻达到平衡状态的是 c (填字母序号)
查看答案和解析>>
科目:高中化学 来源: 题型:
下列化学反应的速率,一定是前者大于后者的( )
|
| A. | 反应A+B |
|
| B. | 相同温度下,与同浓度盐酸反应的锌粉和铁粉产生氢气的速率 |
|
| C. | 相同温度下,颗粒大小相同的生铁分别在水和饱和食盐水中的腐蚀生锈 |
|
| D. | 一定温度下,相同氢离子浓度、相同体积的盐酸与硫酸分别与大小相同的锌片反应,产生气泡的快慢 |
查看答案和解析>>
科目:高中化学 来源: 题型:
氨、甲烷都是重要的氢化物,按要求回答下列问题:
(1)NH3(g)和O2(g)反应生成NO(g)和H2O(g)的△H往往难以直接测量,从产物稳定性看,其主要原因是 .
已知:1molN2(g)反应生成2mol NH3(g)的△H=﹣92kJ•mol﹣1,1mol H2(g)燃烧生成H2O (g) 的△H=﹣242kJ•mol﹣1,1mol N2(g)和O2 (g)完全反应生成NO(g)的△H=+180kJ•mol﹣1.若有17g 氨气经催化氧化完全生成一氧化氮气体和水蒸气所放出的热量为 .
(2)甲烷与水蒸气通入聚焦太阳能反应器,可发生反应的化学方程式为CH4+H2O⇌CO+3H2,该反应为吸热反应.已知在三种不同条件(Ⅰ、Ⅱ、Ⅲ)下,氢气的产量随时间的变化如图1所示.
①在0~20小时内,甲烷的反应速率vⅠ、vⅡ和vⅢ从大到小的顺序为 .
②将0.4mol甲烷和0.4mol水蒸气充入2L恒容的密闭容器中,某条件下反应达到平衡,测得氢气的物质的量浓度为0.3mol•L﹣1,则该条件下此反应的平衡常数K= ,甲烷的转化率为 .
③氢气的百分含量与体系总压强(P)、温度(T)的关系如图2所示.
平衡状态由A变到B时,对应的平衡常数:K(A) K(B)(填“>”、“<”或“=”).
查看答案和解析>>
科目:高中化学 来源: 题型:
下列关于乙醇的说法不正确的是( )
A.可用纤维素的水解产物制取 B. 可由乙烯通过加成反应制取
C.与乙醛互为同分异构体 D. 可以用于制取乙酸乙酯
查看答案和解析>>
科目:高中化学 来源: 题型:
碳纳米管是近年来材料科学研究的热点.为除去碳纳米管中的杂质﹣﹣碳纳米颗粒(少量碳原子的聚集体),可以将样品溶解于强酸性的K2Cr2O7溶液中充分反应,当溶液由橙色转变为墨绿色(Cr3+)即可,同时放出一种无毒的气体.以下判断正确的是( )
|
| A. | 可以用浓盐酸调节K2Cr2O7溶液的酸性 |
|
| B. | 该过程中每氧化2 mol碳纳米颗粒,转移8NA个电子 |
|
| C. | 若将该反应设计为原电池,则碳纳米颗粒应作为原电池的正极 |
|
| D. | 可以通过过滤的方法最终得到碳纳米管 |
查看答案和解析>>
科目:高中化学 来源: 题型:
某化学小组以环己醇制备环己烯(如下图),

(1)制备粗品
将12.5mL环己醇加入试管A中,再加入lmL浓硫酸,摇匀后放入碎瓷片,缓慢加热至反应完全,在试管C内得到环己烯粗品。
① A中碎瓷片的作用是___________,导管B除了导气外还具有的作用是_________;
②试管C置于冰水浴中的目的是____________________________。
(2)制备精品
① 环己烯粗品中含有环己醇和少量酸性杂质等。加入饱和食盐水,振荡、静置、分层,环己烯在_________层(填上或下),分液后用_________ (填字母)洗涤;
a.KMnO4溶液 b.稀H2SO4 c.Na2CO3溶液
② 再将环己烯按右图装置蒸馏,冷却水从_________口进入(填字母)。蒸馏时要加入生石灰,目的是___________________;

③ 收集产品时,控制的温度应在_________左右,实验制得的环己烯精品质量低于理论产量,可能的原因是______(填字母);
a.蒸馏时从70℃开始收集产品
b.环己醇实际用量多了
c.制备粗品时环己醇随产品一起蒸出
(3) 以下区分环己烯精品和粗品的方法,合理的是_________(填字母)。
a.用酸性高锰酸钾溶液 b.用金属钠 c.测定沸点
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com