
各物质之间的转换关系如下图,部分生成物省略。C、D是由X、Y、Z中两种元素组成的化合物,X、Y、Z的原子序数依次增大,在周期表中X的原子半径最小,Y、Z原子量外层电子数之和为12。D为无色非可燃性气体,G为黄绿色单质气体,J、M为金属,l有漂白作用,反应①常用于制作印刷电路板。
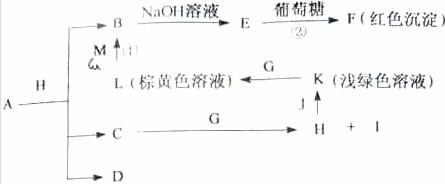
请回答下列问题:(1)写出A的化学式 , C的电子式 。
(2)比较Y与Z的原子半径大小 > (填写元素符号)。
(3)写出反应②的化学方程式(有机物用结构简式表示) ,举出该反应的一个应用实例 。
(4)已知F溶于稀硝酸,溶液变成蓝色,并放出无色气体。请写出该反应的化学方程式 。
(5)研究表明:气体D在一定条件下可被还原为晶莹透明的晶体N,其结构中原子的排列为正四面体,请写出N及其2种同素异形体的名称 、 、 。
【答案】(1)Cu2(OH)2CO3 [Cu(OH)2·CuCO3]或CuCO3  (2) C>O
(2) C>O
(3)CH2OH(CHOH)4CHO + 2Cu(OH)2  CH2OH(CHOH)4COOH + Cu2O↓+ 2H2O医学上可用这个反应检验尿液中的葡萄糖
CH2OH(CHOH)4COOH + Cu2O↓+ 2H2O医学上可用这个反应检验尿液中的葡萄糖
(4)3Cu2O + 14HNO3  6Cu(NO3)2 + 2NO↑+ 7H2O
6Cu(NO3)2 + 2NO↑+ 7H2O
(5)金刚石、石墨、富勒烯(C60)或碳纳米管等。
【解析】从反应图中寻找突破口,E与葡葡糖生成红色沉淀F,则E应为Cu(OH)2,而B为Cu2+,反应①为印刷电路板,L为棕黄色溶液,由此可推出:M应为Cu,L为FeCl3 。G为黄绿色气体,则为Cl2,K为浅绿色,则为Fe2+溶液。X的原子半径最小,则为H,D为非可燃性气体,可推为CO2,C和O的最外层电子之和刚好为12。C为H、C、O中的两种组成的化合物,且可以与Cl2反应,故应为H2O,生成H为HCl,I为HClO(具有漂白性),HCl与J(Fe)可生成FeCl2溶液。(1)A + HCl Cu2+ + H2O + CO2,由元素守恒可知,A可以CuCO3或碱式碳酸铜均可。(2)Y为C,Z为N,两者位于同一周期,前者的半径大,即C>N。(3)葡萄糖含有醛基,可以与Cu(OH)2生成砖红色沉淀。(4)F为Cu2O,与HNO3反应,生成Cu(NO3)2,且生成无色气体,应为NO,然后根据得失电子守恒配平即可。(5)CO2可以还原成正四面体结构的晶体N,即化合价降低,显然生成C,应为金刚石。它的同素异形体必须为含碳的单质
Cu2+ + H2O + CO2,由元素守恒可知,A可以CuCO3或碱式碳酸铜均可。(2)Y为C,Z为N,两者位于同一周期,前者的半径大,即C>N。(3)葡萄糖含有醛基,可以与Cu(OH)2生成砖红色沉淀。(4)F为Cu2O,与HNO3反应,生成Cu(NO3)2,且生成无色气体,应为NO,然后根据得失电子守恒配平即可。(5)CO2可以还原成正四面体结构的晶体N,即化合价降低,显然生成C,应为金刚石。它的同素异形体必须为含碳的单质


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:
雌二醇和睾丸素均属类固醇类化合物,该类化合物的结构特征是含有相同的“三室一厅”(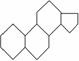 )的核心构架。这两种化合物的结构简式如下:
)的核心构架。这两种化合物的结构简式如下:
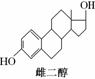
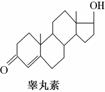
下列关于雌二醇和睾丸素的叙述中,不正确的是( )
A.均能与卤化氢发生取代反应
B.均能发生消去反应
C.均可使溴水褪色
D.两种物质的分子组成相差一个CH2,属于同系物
查看答案和解析>>
科目:高中化学 来源: 题型:
2007年诺贝尔化学奖得主Gerhard Ertl对金属Pt表面催化CO氧化反应的模型进行了深入研究。下列关于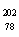 Pt的说法正确的是 ( )
Pt的说法正确的是 ( )
A. 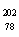 Pt和
Pt和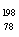 Pt的质子数相同,互称为同位素
Pt的质子数相同,互称为同位素
B. 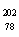 Pt和
Pt和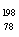 Pt的中子数相同,互称为同位素
Pt的中子数相同,互称为同位素
C. 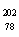 Pt和
Pt和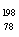 Pt的核外电子数相同,是同一种核素
Pt的核外电子数相同,是同一种核素
D. 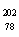 Pt和
Pt和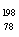 Pt的质量数不同,不能互称为同位素
Pt的质量数不同,不能互称为同位素
查看答案和解析>>
科目:高中化学 来源: 题型:
甲、乙、丙、丁4中物质分别含2种或3种元素,它们的分子中各含18个电子。甲是气态氢化物,在水中分步电离出两种阴离子。下列推断合理的是
A.某酸溶液含甲电离出的阴离子,则该溶液显碱性,只能与酸反应
B.乙与氧气的摩尔质量相同,则乙一定含有极性键和非极性键
C.丙中含有2周期IVA族的元素,则丙一定是甲烷的同系物
D.丁和甲中各元素质量比相同,则丁中一定含有-1价的元素
查看答案和解析>>
科目:高中化学 来源: 题型:
根据中学化学教材所附元素周期表判断,下列叙述不正确的是
A. K层电子为奇数的所有元素所在族的序数与该元素原子的K层电子数相等
B. L层电子为奇数的所有元素所在族的序数与该元素原子的L层电子数相等
C. L层电子为偶数的所有主族元素所在族的序数与该元素原子的L层电子数相等
D. M层电子为奇数的所有主族元素所在族的序数与该元素原子的M层电子数相等
查看答案和解析>>
科目:高中化学 来源: 题型:
甲、乙为短周期不同主族元素组成的单质,丙、丁为氧化物,它们存在如下转化关系, ,满足条件的甲和乙为 ( )
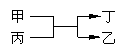 A.铝和铁 B.氟气和氧气 C.碳和硅 D.镁和碳
A.铝和铁 B.氟气和氧气 C.碳和硅 D.镁和碳
查看答案和解析>>
科目:高中化学 来源: 题型:
下列有关化学用语正确的是 ( )
①乙烯的最简式C2H4 ②乙醇的结构简式C2H6O
③四氯化碳的电子式 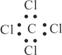 ④乙炔的结构简式CHCH
④乙炔的结构简式CHCH
⑤乙烷的结构式CH3CH3 ⑥乙醛的结构简式CH3COH
A.全对 B.全错 C.③④⑤ D.③④⑥
查看答案和解析>>
科目:高中化学 来源: 题型:
工业上常用天然气作为制备CH3OH的原料。已知:
① CH4(g)+O2(g)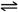 CO(g)+H2(g)+H2O(g) △H=-321.5 kJ/mol
CO(g)+H2(g)+H2O(g) △H=-321.5 kJ/mol
② CH4(g)+ H2O(g) 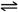 CO(g)+3H2(g) △H=+250.
CO(g)+3H2(g) △H=+250. 3 kJ/mol
3 kJ/mol
③ CO(g)+2H2(g) 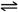 CH3OH(g) △H=-90.0 kJ/mol
CH3OH(g) △H=-90.0 kJ/mol
(1)CH4(g)与O2(g)反应生成CH3OH(g)的热化学方程式为_________________________。
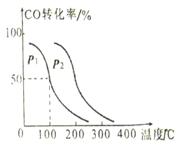
(2)向V L恒容密闭容器中充入a mol CO与2a mol H2,在不同压强下
合成甲醇。CO 的平衡转化率与温度、压强的关系如下图所示:
① 压强P1____P2(填“<”、“>”或“=”)
② 在100℃、P1压强时,平衡常数为________ (用含a、V的代数式表示)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com