
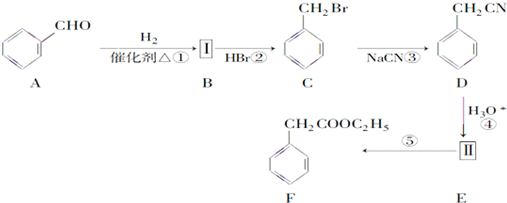
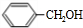 ,苯甲醇与HBr发生取代反应生成C,C与NaCN发生取代反应生成D,由F的结构可知,D在酸性条件下反应生成Ⅱ为
,苯甲醇与HBr发生取代反应生成C,C与NaCN发生取代反应生成D,由F的结构可知,D在酸性条件下反应生成Ⅱ为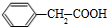 ,苯乙酸与乙醇发生酯化反应生成苯乙酸乙酯.
,苯乙酸与乙醇发生酯化反应生成苯乙酸乙酯.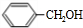 ,苯甲醇与HBr发生取代反应生成C,C与NaCN发生取代反应生成D,由F的结构可知,D在酸性条件下反应生成Ⅱ为
,苯甲醇与HBr发生取代反应生成C,C与NaCN发生取代反应生成D,由F的结构可知,D在酸性条件下反应生成Ⅱ为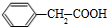 ,苯乙酸与乙醇发生酯化反应生成苯乙酸乙酯,
,苯乙酸与乙醇发生酯化反应生成苯乙酸乙酯,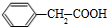 ,含氧官能团的是羧基,故答案为:-C≡N;羧基;
,含氧官能团的是羧基,故答案为:-C≡N;羧基;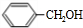 ,在一定条件下能与液溴发生取代反应,故B错误;
,在一定条件下能与液溴发生取代反应,故B错误;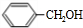 )可以与CH3COOH发生酯化反应,属于取代反应,则反应③为取代反应,反应类型相同,故C正确;
)可以与CH3COOH发生酯化反应,属于取代反应,则反应③为取代反应,反应类型相同,故C正确;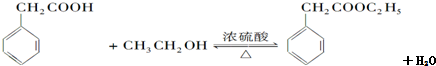 ,
,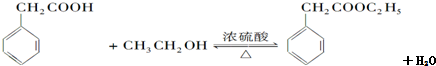 ;
; ,
, .
.


科目:高中化学 来源: 题型:
| A、几千万年前地球上一条恐龙体内的某个原子可能在你的身体里 |
| B、在化学变化中,分子可以再分,离子和原子不可以再分 |
| C、一定条件下,金属钠可以成为绝缘体 |
| D、一定条件下,水在20℃时能凝固成固体 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 食物 | 橘子汁 | 朝鲜泡菜 | 牛奶 | 鸡蛋清 |
| 近似pH范围 | 3.0~4.0 | 3.2~3.6 | 6.3~6.6 | 7.6~8.0 |
| A、鸡蛋清显碱性 |
| B、胃酸过多的人应少吃朝鲜泡菜 |
| C、橘子汁能使石蕊试液变红 |
| D、牛奶比鸡蛋清的碱性强 |
查看答案和解析>>
科目:高中化学 来源: 题型:
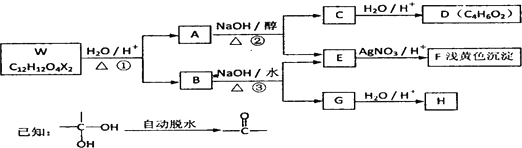
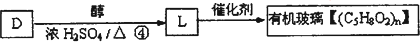
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、Mg、Al |
| B、Mg、Cu |
| C、Cu、Zn |
| D、Al、Fe |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、将温度计水银球插入蒸馏烧瓶的石油中来蒸馏石油 |
| B、混有乙烯的乙烷气体中通入足量的氢气发生反应,得到纯净的乙烷 |
| C、向某溶液中滴加KSCN溶液,溶液不变色,滴加氯水后溶液显红色,该溶液中一定含Fe2+ |
| D、将Cl2通入KI溶液,溶液变蓝色说明I-的还原性强于Cl- |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com