
无水氯化铝是一种重要的催化剂,工业上由Al2O3制备无水氯化铝的反应为2Al2O3(s)+6Cl2(g)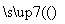 4AlCl3(g)+3O2(g) ΔH>0。下列分析错误的是( )
4AlCl3(g)+3O2(g) ΔH>0。下列分析错误的是( )
A.增大反应体系的压强,反应速率加快
B.加入碳粉,平衡向右移动,原因是碳与O2反应,降低了生成物的浓度且放出热量
C.电解熔融的Al2O3和AlCl3均能得到单质铝
D.将AlCl3·6H2O在氯化氢气流中加热,也可制得无水氯化铝
科目:高中化学 来源: 题型:
下列各选项所描述的两个量中,前者一定大于后者的是
A.NH4NO3溶液中NH4+和NO3-的数目
B.纯水在80℃和25℃时的pH
C.pH与体积都相同的氨水和NaOH溶液分别用0.1 mol·L-1盐酸恰好中和,所需的盐酸体积
D.相同温度下,pH =12的NaOH溶液和Na2CO3溶液中由水电离出的c (OH-)
查看答案和解析>>
科目:高中化学 来源: 题型:
向甲乙两个容积均为1 L的恒容容器中,分别充入2 mol A、2 mol B和1 mol A、1 mol B。相同条件下(温度T ℃),发生下列反应:A(g)+B(g)xC(g) ΔH<0。测得两容器中c(A)随时间t的变化如图所示:
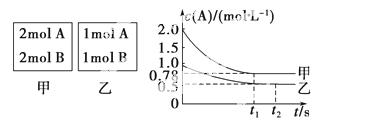
回答下列问题:
(1)乙容器中,平衡后物质B的转化率为________。
(2)x=________。
(3)T ℃时该反应的平衡常数为________。
(4)下列说法正确的是( )。
A.向平衡后的乙容器中充入氦气可使c(A)增大
B.将乙容器单独升温可使乙容器内各物质的体积分数与甲容器内相同
C.若向甲容器中再充入2 mol A、2 mol B,则平衡时甲容器中0.78 mol·L-1<c(A)<1.56 mol·L-1
查看答案和解析>>
科目:高中化学 来源: 题型:
用CaSO4代替O2与燃料CO反应,既可以提高燃烧效率,又能得到高纯CO2,是一种高效、清洁、经济的新型燃烧技术,反应①为主反应,反应②和③为副反应。
①1/4CaSO4(s)+CO(g) 1/4CaS(s)+CO2(g) △H1=-47.3kJ/mol
1/4CaS(s)+CO2(g) △H1=-47.3kJ/mol
②CaSO4(s)+CO(g) CaO(s)+ CO2(g)+ SO2(g) △H2=+210.5kJ/mol
CaO(s)+ CO2(g)+ SO2(g) △H2=+210.5kJ/mol
③CO(g) 1/2C(s)+1/2CO2(g) △H3=-86
1/2C(s)+1/2CO2(g) △H3=-86 .2kJ/mol
.2kJ/mol
(1)反应2 CaSO4(s)+7CO(g) CaS(s)+CaO(s)+C(s)+6CO2(g)+SO2(g)的△H= (用△H1△H2△H3表示)。
CaS(s)+CaO(s)+C(s)+6CO2(g)+SO2(g)的△H= (用△H1△H2△H3表示)。
(2)反应①~③的平衡常数的对数lgK随反应温度T的变化曲线见图18.结合各反应的△H,归纳lgK~T曲线变化规律:
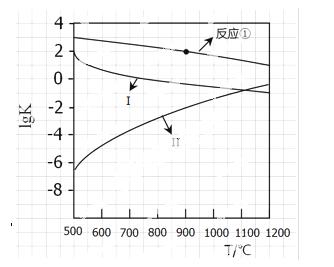
a)
b)
(3)向盛有CaSO4的真空恒容容器中充入CO,反应①于900 ºC达到平衡,c平衡(CO)=8.0×10-5mol·L-1,计算CO的转化率(忽略副反应,结果保留2位有效数字)。
(4)为减少副产物,获得更纯净的CO2,可在初始燃料中适量加入 。
(5)以反应①中生成的CaS为原料,在一定条件下经原子利用率100%的高温反应,可再生成CaSO4,该反应的化学方程式为 ;在一定条件下CO2可与对二甲苯反应,在其苯环上引入一个羧基,产物的结构简式为 。
查看答案和解析>>
科目:高中化学 来源: 题型:
镍具有优良的物理和化学特性,是许多领域尤其是高技术产业的重要原料。羰基法提纯粗镍涉及的两步反应依次为:
①Ni(s)+4CO(g)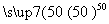 Ni(CO)4(g)+Q
Ni(CO)4(g)+Q
②Ni(CO)4(g)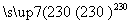 Ni(s)+4CO(g)
Ni(s)+4CO(g)
完成下列填空:
(1)在温度不变的情况下,要提高反应①中Ni(CO)4的产率,可采取的措施有____________、____________ 。
(2)若反应②达到平衡后,保持其他条件不变,降低温度,重新达到平衡时_______________ 。
a.平衡常数K增大 b.CO的浓度减小
c.Ni的质量减小 d.v逆[Ni(CO)4]增大
(3)简述羰基法提纯粗镍的操作过程。
______________________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
T ℃时,在1 L的密闭容器中充入2 mol CO2和6 mol H2,一定条件下发生反应:CO2(g)+3H2(g)  CH3OH(g)+H2O(g) ΔH=-49.0 kJ·mol-1,测得H2和CH3OH(g)的浓度随时间变化如下表所示。下列说法不正确的是( )
CH3OH(g)+H2O(g) ΔH=-49.0 kJ·mol-1,测得H2和CH3OH(g)的浓度随时间变化如下表所示。下列说法不正确的是( )
| 时间/min | c(H2)/mol·L-1 | c(CH3OH)/mol·L-1 | v(正)和v(逆)比较 |
| t0 | 6 | 0 | ? |
| t1 | 3 | 1 | v(正)=v(逆) |
A.t0~t1时间内v(H2)=3/(t1-t0) mol·L-1·min-1
B.t1时,若升高温度或再充入CO2气体,都可以提高H2的转化率
C.t0时,v(正)>v(逆)
D.T ℃时,平衡常数K=1/27,CO2与H2的转化率相等
查看答案和解析>>
科目:高中化学 来源: 题型:
(1)利用H2S废气制取氢气的方法有多种。
①高温热分解法
已知:H2S(g)  H2(g)+
H2(g)+ S2(g)
S2(g)
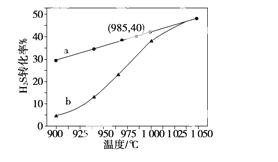
在恒容密闭容器中,控制不同温度进行H2S分解实验。以H2S起始浓度均为c mol·L-1测定H2S的转化率,结果见右图。图中a为H2S的平衡转化率与温度关系曲线,b曲线表示不同温度下反应经过相同时间且未达到化学平衡时H2S的转化率。据图计算985 ℃时H2S按上述反应分解的平衡常数K=________;说明随温度的升高,曲线b向曲线a逼近的原因:__________________________。
(2)CuBr2分解的热化学方程式为:
2CuBr2(s)  2CuBr(s)+Br2(g) ΔH=+105.4 kJ/mol
2CuBr(s)+Br2(g) ΔH=+105.4 kJ/mol
在密闭容器中将过量CuBr2于487 K下加热分解,平衡时p(Br2)为4.66×103 Pa。
①如反应体系的体积不变,提高反应温度,则p(Br2)将会_______________(填“增大”、“不变”或“减小”)。
②如反应温度不变,将反应体系的体积增加一倍,则p(Br2)的变化范围为________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
0.5L 1mol/L的FeCl3溶液与0.2L 1 mol/L的KCl溶液中,Cl-的物质的量浓度之比为( )
A.15∶2 B.1∶1 C.3∶1 D.1∶3
查看答案和解析>>
科目:高中化学 来源: 题型:
现有常温时pH=1的某强酸溶液10 mL,下列操作能使溶液的pH变成2的是( )
A.加水稀释成100 mL
B.加入10 mL的水进行稀释
C.加入10 mL 0.01 mol/L的NaOH溶液
D.加入10 mL 0.01 mol/L的HCl溶液
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com