
【题目】X(g)+3Y(g)![]() 2Z(g) ΔH=-akJ·mol-1,一定条件下,将1molX和3molY通入2L的恒容密闭容器中,反应10min,测得Y的物质的量为2.4mol。下列说法正确的是
2Z(g) ΔH=-akJ·mol-1,一定条件下,将1molX和3molY通入2L的恒容密闭容器中,反应10min,测得Y的物质的量为2.4mol。下列说法正确的是
A.10min内,Y的平均反应速率为0.03mol·L-1·s-1
B.第10min时,X的反应速率为0.01mol·L-1·min-1
C.10min内,消耗0.2molX,生成0.4molZ
D.10min内,X和Y反应放出的热量为akJ
【答案】C
【解析】
反应10min,测得Y的物质的量为2.4mol,则Y消耗的物质的量为:3mol2.4mol=0.6mol,根据反应X(g)+3Y(g)2Z(g)可知,10min内消耗0.2molX、生成0.4molZ,
A.10min内,Y的平均反应速率为:0.6mol2L10min=0.03molL1min1,故A错误;
B.化学反应速率与化学计量数成正比,则10min内X的反应速率为:v(X)=13×v(Y)=0.01molL1min1,该速率为平均速率,无法计算及时速率,故B错误;
C.根据分析可知,10min内,消耗0.2molX,生成0.4molZ,故C正确;
D.由于该反应为可逆反应,则1molX和3molY通入2L的恒容密闭容器中生成Z的物质的量小于2mol,放出的热量小于akJ,故D错误;
故选C。


科目:高中化学 来源: 题型:
【题目】下列解释事实的方程式正确的是
A.工业冶炼氯化铝制氯单质:2AlCl3(熔融)![]() 2Al+3Cl2↑
2Al+3Cl2↑
B.向氯化铝溶液中加入过量氨水,产生白色沉淀:Al3+ + 3OH- = Al(OH)3↓
C.将铁粉与水蒸气共热,产生气体:2Fe+3H2O(g)![]() Fe2O3+3H2
Fe2O3+3H2
D.电解饱和氯化钠溶液,产生气体:2NaCl+2H2O![]() 2NaOH+H2↑+Cl2↑
2NaOH+H2↑+Cl2↑
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】三氯化六氨合钴[Co(NH3)6]Cl3 是橙黄色、微溶于水的配合物,是合成其它一些含钴配合物的原料。下图是某科研小组以含钴废料(含少量Fe、Al 等杂质)制取[Co(NH3)6]Cl3 的工艺流程:
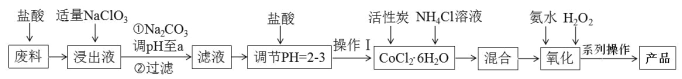
回答下列问题:
(1)写出加“适量NaClO3”发生反应的离子方程式______________。
(2)“加Na2CO3 调pH至a”会生成两种沉淀,分别为_______________________(填化学式)。
(3)操作Ⅰ的步骤包括_____________________________、冷却结晶、减压过滤。
(4)流程中NH4Cl除作反应物外,还可防止加氨水时c(OH-) 过大,其原理是_________________。
(5)“氧化”步骤,甲同学认为应先加入氨水再加入H2O2,乙同学认为试剂添加顺序对产物无影响。你认为___________(填“甲”或“乙”)同学观点正确,理由是_________________________________。写出该步骤的化学方程式:________________________________
(6)通过碘量法可测定产品中钴的含量。将 [Co(NH3)6]Cl3 转化成Co3+后,加入过量KI 溶液,再用Na2S2O3标准液滴定(淀粉溶液做指示剂),反应原理:2Co3++2I-=2Co2++I2,I2+2S2O32-=2I-+S4O62-,实验过程中,下列操作会导致所测钴含量数值偏高的是_______。
a.用久置于空气中的 KI 固体配制溶液
b.盛装Na2S2O3标准液的碱式滴定管未润洗
c.滴定结束后,发现滴定管内有气泡
d.溶液蓝色退去,立即读数
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】硫酸锌是制造锌钡白和锌盐的主要原料,也可用于湿法电解制锌,如图为由锌灰制ZnSO4·7H2O晶体的工艺流程。

已知:
①锌灰的主要成分为ZnO,还含有CuO、PbO、MnO和FeO;
②“滤渣2”的主要成分为Fe(OH)3和MnO(OH)2。
请回答下列问题:
(1)MnO(OH)2中Mn元素的化合价为___。
(2)为提高浸出效率,锌灰在“酸浸”前可采取的措施有___;“酸浸”时,若硫酸浓度过高,可能发生副反应的化学方程式为___。
(3)“滤渣1”的主要成分为___。
(4)“氧化”时,需控制溶液的pH=5.1,Fe2+被氧化的离子方程式为___。
(5)操作a为___、过滤、洗涤、干燥。
(6)ZnSO4·7H2O产品的纯度可用配位滴定法测定。
准确称取一定量的ZnSO4·7H2O晶体加入250mL的锥形瓶中,加水约20mL,再加入2-3滴5%的二甲酚橙作指示剂、约5mL六亚甲基四胺缓冲溶液,摇匀。用已标定的0.0160mol·L-1EDTA溶液滴定,滴定至溶液由红紫色变成亮黄色,即为终点(ZnSO4·7H2O与EDTA按物质的量之比1:1反应)。实验数据如下表:

ZnSO4·7H2O产品的纯度为___ (保留2位有效数字)。
(7)工业上采用惰性电极作阳极电解ZnSO4溶液可实现湿法炼锌,电解过程中的离子方程式为___。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】盐酸罗匹尼罗用于治疗帕金森症,治疗中度到重度的不宁腿(多动腿)综合症,罗匹尼罗(H)的一种合成路线如图所示。
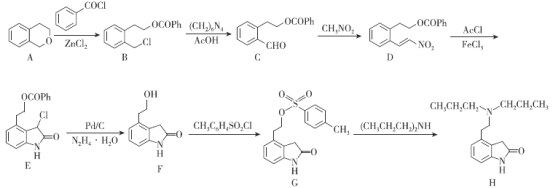
已知:①路线中Ph-代表![]() ,Ac-代表CH3COO-;
,Ac-代表CH3COO-;
②RCOOR’![]() R’OH
R’OH
请回答下列问题:
(1)D中含氧官能团的名称为___。
(2)E的分子式为___;一定条件下,1molE最多与___molH2发生加成反应(不考虑开环加成)。
(3)G→H的反应类型为___。
(4)A→B的化学方程式为___。
(5)同时满足下列条件的A的同分异构体有___种(不考虑立体异构);
①含苯环②遇FeCl3溶液显紫色③有两个取代基
其中核磁共振氢谱为5组峰且峰面积之比为4:2:2:1:1的结构简式为___。
(6)参照上述合成路线,请设计以![]() 为起始原料制备
为起始原料制备![]() 的合成路线为___(其他无机试剂任选)。
的合成路线为___(其他无机试剂任选)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知:
①2H2(g)+O2(g)===2H2O(l) ΔH=-571.6 kJ·mol-1
②2CH3OH(l)+3O2(g)===2CO2(g)+4H2O(l) ΔH=-1452 kJ·mol-1
③H+(aq)+OH-(aq)===H2O(l) ΔH=-57.3 kJ·mol-1
则下列说法正确的是
A. H2(g)的燃烧热为571.6 kJ·mol-1
B. ![]() H2SO4(aq)+
H2SO4(aq)+![]() Ba(OH)2(aq)===
Ba(OH)2(aq)===![]() BaSO4(s)+H2O(l) ΔH=-57.3 kJ·mol-1
BaSO4(s)+H2O(l) ΔH=-57.3 kJ·mol-1
C. 同质量的H2(g)和CH3OH(l)完全燃烧,H2(g)放出的热量多
D. 2molH2(g)在足量氧气中完全燃烧生成气态水放出热量大于571.6kJ
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在密闭容器中进行反应X2(g)+Y2(g)![]() 2Z(g),已知X2、Y2、Z的起始浓度分别为0.1 mol·L-1、0.2 mol·L-1、0.2 mol·L-1,在一定条件下,当反应达到平衡时,各物质的浓度有可能是
2Z(g),已知X2、Y2、Z的起始浓度分别为0.1 mol·L-1、0.2 mol·L-1、0.2 mol·L-1,在一定条件下,当反应达到平衡时,各物质的浓度有可能是
A. Z为0.2 mol·L-1 B. Y2为0.35 mol·L-1
C. X2为0.3 mol·L-1 D. Z为0.4 mol·L-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有机物A是天然橡胶的单体。有机物F是一种环保型塑料,一种合成路线如图所示:
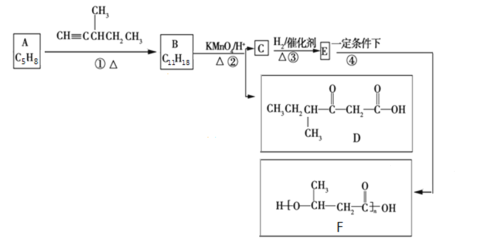
已知:
①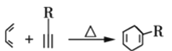
②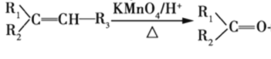 +R3-COOH(—R1、—R2、—R3、—R均为烃基)
+R3-COOH(—R1、—R2、—R3、—R均为烃基)
请回容下列问题:
(1)A用系统命名法命名为__________________________。
(2)A分子与Cl2分子发生1:1加成时,其产物种类有____________种(不考虑立体异构)。
(3)B与足量H2反应后的产物的结构简式为![]() ,则B的结构简式为___________________,1个B分子中有________个手性碳原子。
,则B的结构简式为___________________,1个B分子中有________个手性碳原子。
(4)C分子中的官能团名称为_____________________。
(5)写出反应④的化学方程式:______________________________________________________。
(6)G是C的同分异构体,G能发生水解反应和银镜反应,1个G分子中含有2个碳氧双键,则G的可能结构共有___________种(不考虑立体异构)。
(7)设计由有机物D和甲醇为起始原料制备CH3CH2CH(CH3)CH =CHCOOCH3的合成路线______________(无机试剂任选)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下表是元素周期表的一部分,按要求回答下列问题:
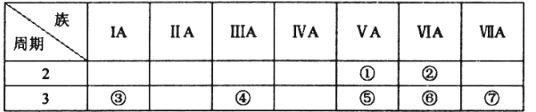
(l)①的简单氢化物的电子式:_________________
(2)⑥的原子结构示意图:________________
(3)⑤、⑥、⑦的最高价氧化物对应水化物的酸性由强到弱的顺序为________________(用化学式表示),③的最高价氧化物对应水化物中含有的化学键的类型为________________
(4)能证明元素⑦比元素⑥的非金属性强的实验事实的是__________ (填字母)
A.常温下元素⑦的单质为气态,而元素⑥的单质为固态
B.元素⑦的气态氢化物比元素⑥的气态氢化物稳定
C.元素⑦的氧化物对应水化物比⑥的氧化物对应水化物酸性强
D.元素⑦的单质能与⑥的氢化物溶液反应生成⑥的单质
(5)④的单质在空气中因表面氧化可以形成致密的氧化物保护膜,从而可以保护内部的单质不被氧化,该氧化物与NaOH溶液反应的离子方程式为____________________________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com