
| A. | 四种元素位于同一周期 | B. | b+1=d-1 | ||
| C. | 氢化物稳定性:H2Y>HZ | D. | 离子的氧化性:W3+>X+ |
分析 1-18号元素的离子aW3+、bX+、cY2-、dZ-都具有相同的电子层结构,即它们核外电子数相等,所以a-3=b-1=c+2=d+1,阳离子位于阴离子下一周期,在1-18号元素中只有金属Al能形成和上一周期阴离子具有电子层结构,所以W是Al元素,则X、Y、Z分别是Na、O、F元素,
A.四种元素位于不同周期;
B.阳离子核外电子数=质子数-电荷数,阴离子核外电子数=质子数+电荷数;
C.元素的非金属性越强,其氢化物的稳定性越强;
D.元素的金属性越强,其阳离子氧化性越弱.
解答 解:1-18号元素的离子aW3+、bX+、cY2-、dZ-都具有相同的电子层结构,即它们核外电子数相等,所以a-3=b-1=c+2=d+1,阳离子位于阴离子下一周期,在1-18号元素中只有金属Al能形成和上一周期阴离子具有电子层结构,所以W是Al元素,则X、Y、Z分别是Na、O、F元素,
A.W和X位于第三周期、Y和Z位于第二周期,所以这四种元素位于不同周期,故A错误;
B.阳离子核外电子数=质子数-电荷数,阴离子核外电子数=质子数+电荷数,所以存在b-1=d+1,故B错误;
C.元素的非金属性越强,其氢化物的稳定性越强,非金属性Z>Y,所以氢化物稳定性:H2Y<HZ,故C错误;
D.元素的金属性越强,其阳离子氧化性越弱,金属性X>W,所以离子的氧化性:W3+>X+,故D正确;
故选D.
点评 本题考查原子结构和元素性质,正确判断元素是解本题关键,知道阴阳离子核外电子数计算方法,易错选项是D.


科目:高中化学 来源: 题型:解答题
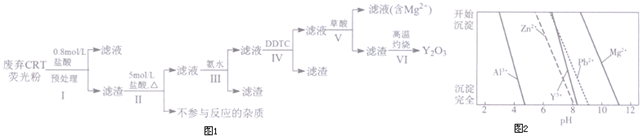
| 成分 含量/% 阶段 | Y2O3 | ZnO | Al2O3 | PbO2 | MgO |
| 预处理前 | 24.28 | 41.82 | 7.81 | 1.67 | 0.19 |
| 预处理后 | 68.51 | 5.42 | 4.33 | 5.43 | 0.50 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | $\frac{c(O{H}^{-})•c(N{H}_{4}^{+})}{c(N{H}_{3}•{H}_{2}O)}$ | B. | $\frac{c(N{H}_{3}•{H}_{2}O)}{c(O{H}^{-})}$ | ||
| C. | c(H+)和c(OH-)的乘积 | D. | OH-的物质的量 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| R | |||
| T | Q | W |
| A. | 原子半径:T>Q>R | |
| B. | 最简单气态氢化物的还原性:R>Q | |
| C. | 含T的盐溶液一定显酸性 | |
| D. | 最高价氧化物对应水化物的酸性:Q<W |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ⅠA族金属元素是同周期中金属性最强的元素 | |
| B. | 同种元素的原子均有相同的质子数和中子数 | |
| C. | 非金属元素组成的化合物中只含共价键 | |
| D. | ⅦA族元素的阴离子还原性越强,其最高价氧化物对应水化物的酸性越强 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 苯酚能跟NaOH溶液反应,乙醇不能与NaOH溶液反应 | |
| B. | 乙烯能发生加成反应,乙烷不能发生加成反应 | |
| C. | 甲苯能使高锰酸钾酸性溶液褪色,甲烷和苯不能使高锰酸钾酸性溶液褪色 | |
| D. | 苯与硝酸在50~60°C发生取代反应,甲苯与硝酸在30°C就能发生取代反应 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com