
一水草酸钙(CaC2O4·H2O)可用作分离稀有金属的载体。其制备方法如下:
步骤I:用精制氯化钙稀溶液与草酸溶液共热反应,过滤,将固体溶于热盐酸中。
步骤Ⅱ:加氨水反应得一水草酸钙沉淀,过滤,热水洗涤,在105℃干燥得产品。
(1)写出步骤Ⅱ发生反应的化学方程式 。
(2)已知CaC2O4·H2O的Ksp = 2.34×10-9,为使步骤Ⅱ溶液中c(C2O42-)≤1×10-5 mol·L-1,c(Ca2+)的范围为 。
(3)为研究一水草酸钙的热分解性质,进行如下实验:准确称取36.50g样品加热,样品的固体残留率( )随温度的变化如下图所示。
)随温度的变化如下图所示。

①300℃时残留固体的成分为 ,900℃时残留固体的成分为 。
②通过计算求出500℃时固体的成分及质量。(写出计算过程)
【答案】(1)H2C2O4+CaCl2+2NH3∙H2O=CaC2O4∙H2O↓+2NH4Cl+H2O;(2)≥2.34×10-4mol/L;
(3)①CaC2O4;CaO;②500℃时残留固体的成分为CaC2O4和CaCO3的混合物;样品中CaC2O4∙H2O的物质的量为n(CaC2O4∙H2O)=36. 50g/146g/ mol=0.25mol;设混合物中CaC2O4和CaCO3的的物质的量分别是xmol和ymol,根据500℃时固体总质量,可得128x+100y=36. 50g×76.16%;根据Ca元素守恒,可得x+y=0.25.解放出组可得x=0.1,y=0.15 。m(CaC2O4)=0.1mol×128g/mol=12.8g;m(CaCO3)= 0.15mol×100g/mol=15.0g。
【解析】
试题分析:在步骤I得到精制H2C2O4和CaCl2,然后向该溶液中加入浓氨水发生反应产生一水合草酸钙。发生该反应的方程式是:H2C2O4+CaCl2+2NH3∙H2O=CaC2O4∙H2O↓+2NH4Cl+H2O;(2)由于CaC2O4·H2O的Ksp = c(C2O42-)×c(Ca2+)=2.34×10-9,所以为使步骤Ⅱ溶液中c(C2O42-)≤1×10-5 mol·L-1,c(C2O42-)×c(Ca2+)≥2.34×10-9,(Ca2+)>2.34×10-9÷1×10-5 mol/L =2.34×10-4mol/L。即c(Ca2+)的范围为≥2.34×10-4mol/mol;(3)CaC2O4·H2O 可能发生的分解反应是:CaC2O4·H2O CaC2O4·H2O,146g CaC2O4·H2O完全分解产生128g CaC2O4, 样品的固体残留率是(128g÷146g)×100%=87.67%,所以在300℃时残留固体的成分为CaC2O4;CaC2O4·H2O
CaC2O4·H2O,146g CaC2O4·H2O完全分解产生128g CaC2O4, 样品的固体残留率是(128g÷146g)×100%=87.67%,所以在300℃时残留固体的成分为CaC2O4;CaC2O4·H2O CaCO3+CO↑+ H2O, 样品的固体残留率是(100g÷146g)×100%=68.49%, CaC2O4·H2O
CaCO3+CO↑+ H2O, 样品的固体残留率是(100g÷146g)×100%=68.49%, CaC2O4·H2O CaO+CO2↑+CO↑+H2O。(56g÷146g) ×100%=38.36%,所以在900℃时残留固体的成分为CaO;由于在500℃时固体残留率是87.67%,>76.16%>68.49%;所以固体中应该含有的CaC2O4和CaCO3。样品中CaC2O4∙H2O的物质的量为n(CaC2O4∙H2O)=36. 50g/146g/ mol=0.25mol;设混合物中CaC2O4和CaCO3的的物质的量分别是xmol和ymol,根据500℃时固体总质量,可得128x+100y=36. 50g×76.16%;根据Ca元素守恒,可得x+y=0.25.解放出组可得x=0.1,y=0.15 。m(CaC2O4)=0.1mol×128g/mol=12.8g;m(CaCO3)= 0.15mol×100g/mol=15.0g。
CaO+CO2↑+CO↑+H2O。(56g÷146g) ×100%=38.36%,所以在900℃时残留固体的成分为CaO;由于在500℃时固体残留率是87.67%,>76.16%>68.49%;所以固体中应该含有的CaC2O4和CaCO3。样品中CaC2O4∙H2O的物质的量为n(CaC2O4∙H2O)=36. 50g/146g/ mol=0.25mol;设混合物中CaC2O4和CaCO3的的物质的量分别是xmol和ymol,根据500℃时固体总质量,可得128x+100y=36. 50g×76.16%;根据Ca元素守恒,可得x+y=0.25.解放出组可得x=0.1,y=0.15 。m(CaC2O4)=0.1mol×128g/mol=12.8g;m(CaCO3)= 0.15mol×100g/mol=15.0g。
考点:考查温度对物质分解产物成分的影响、溶度积常数的应用、物质化学性质的方程式表示、混合物中各组分含量的计算的知识。


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
下列说法错误的是
A. PM2.5又称细颗粒物,是指空气动力学当量直径小于等于2.5微米的颗粒物。因其粒径小,面积大,活性强,易附带有毒、有害物质(例如,重金属、微生物等),对人体健康和大气环境质量的影响更大
B. “水滴石穿”主要是溶解了CO2的雨水与CaCO3长期作用,生成了可溶性的Ca(HCO3)2
C. 食品安全已成为各地政府和公众关注的热点话题,严禁向食品中添加任何非食用物质和滥用食品添加剂
D. 一氧化碳有毒,生有煤炉的居室,可放置数盆水,这样可有效地吸收一氧化碳,以防煤气中毒
查看答案和解析>>
科目:高中化学 来源: 题型:
A、B、C、X均为中学化学常见的物质,它们之间有如下转化关系(其它产物已略去):

下列说法不正确的是
A.若A是NH3则C可能是氧化物
B.若A是非金属单质,则C与水反应的生成物为强酸
C若X是金属单质,则B、C 中X的化合价可能是B>C
D.若X是强碱,则B可能是两性物质
查看答案和解析>>
科目:高中化学 来源: 题型:
下列关于物质性质与应用的说法正确的是 ( )
A.碳具有还原性,高温条件下能将二氧化硅还原为硅
B.二氧化硫有漂白、杀菌性能,可在食品加工中大量使用
C.二氧化硅是半导体材料,可将太阳能直接转化为电能
D.二氧化锰具有较强的的氧化性,可作H2O2分解的氧化剂
查看答案和解析>>
科目:高中化学 来源: 题型:
下列说法中正确的是 ( )
A.常温下,某难溶物的Ksp为2.5×105
B.镀铜铁制品镀层受损后,铁制品比受损前更容易生锈
C.NH3·H2O溶液加水稀释后,溶液中 的值增大
的值增大
D.常温下,pH均为5的盐酸与氯化铵溶液中,水的电离程度相同
查看答案和解析>>
科目:高中化学 来源: 题型:
美托洛尔是一种治疗高血压的药物的中间体,可以通过以下方法合成:
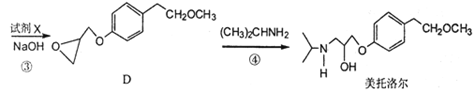
请回答下列问题:
(1)美托洛尔中的含氧官能团为 和 (填名称)。
(2)反应③中加入的试剂X的分子式为C2H5OCl,X的结构简式为 。
(3)在上述①②③三步反应中,属于取代反应的是 (填序号)。
(4)B的一种同分异构体满足下列条件:
Ⅰ.能发生银镜反应 Ⅱ.能与FeCl3溶液发生显色反应
Ⅲ.分子中有4种不同化学环境的氢,且1 mol该物质与金属钠反应产生 1 mol H2。
写出一种该同分异构体的结构简式: 。
(5)根据已有知识并结合题目所给相关信息,写出以CH3OH和 为原料制备
为原料制备 的合成路线流程图(无机试剂任用)。合成路线流程图示例如下:
的合成路线流程图(无机试剂任用)。合成路线流程图示例如下:

查看答案和解析>>
科目:高中化学 来源: 题型:
如下图所示,图Ⅰ是恒压密闭容器,图Ⅱ是恒容密闭容器。当其它条件相同时,在Ⅰ、Ⅱ中分别加入2 mol X和2 mol Y,开始时容器的体积均为V L,发生如下反应并达到平衡状态: 2X(?)+Y(?) aZ(g)。此时Ⅰ中X、Y、Z的物质的量之比为1∶3∶2。下列判断正确的是
aZ(g)。此时Ⅰ中X、Y、Z的物质的量之比为1∶3∶2。下列判断正确的是
A.物质Z的化学计量数a = 2
B.若Ⅱ中气体的密度如图Ⅲ所示,则X、Y中
只有一种为气态
C.若X、Y均为气态,则在平衡时X的转化率:
Ⅰ﹤Ⅱ
D.若X为固态、Y为气态,则Ⅰ、Ⅱ中从开
始到平衡所需的时间:Ⅰ>Ⅱ
查看答案和解析>>
科目:高中化学 来源: 题型:
将一定量的氨基甲酸铵固体置于某容积恒定的真空容器中,发生反应:H2NCOONH4(s)⇌2NH3(g)+CO2(g)在不同温度下,该反应平衡状态部分数据见表.下列说法正确的是( )
| 温度 | 平衡浓度/(mol L﹣1) | |
| c(NH3) | c(CO2) | |
| T1 | 0.1 | |
| T2 | 0.1 |
|
| A. | 若T2>T1,则该反应的△H<0 |
|
| B. | 向容器中充入N2,H2NCOONH4质量增加 |
|
| C. | NH3体积分数不变时,说明该反应达到平衡 |
|
| D. | T1、T2时,H2NCOONH4转化的△n(T2)=2△n(T1) |
查看答案和解析>>
科目:高中化学 来源: 题型:
下列制取、检验、提纯或保存物质的方法可行的是( )
①向某溶液中加入KSCN溶液,检验该溶液是否含有Fe3+
②用植物油、NaOH溶液制取肥皂 ③向FeCl3饱和溶液中滴加NaOH溶液制取Fe(OH)3胶体 ④用焰色反应检验K+时需透过蓝色钴玻璃观察 ⑤少量液溴用水液封后密封保存在棕色试剂瓶中 ⑥向混有乙酸的乙酸乙酯中加入NaOH溶液后再分液,提纯乙酸乙酯
A.①③⑤⑥ B.②④⑤⑥ C.①②④⑤ D.①③④⑥
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com