
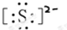 ;
;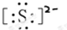
| 2.0g |
| 40g/mol |
| 0.02mol×40g/mol |
| 20.0g |


 黄冈创优卷系列答案
黄冈创优卷系列答案科目:高中化学 来源: 题型:
| ||
| A、CuFeS2中只有硫元素被氧化 |
| B、每生成1mol SO2,反应中共转移6mol电子 |
| C、该反应中有两种物质作氧化剂 |
| D、CuFeS2中被氧化和被还原的原子数目之比为2:1 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、16O和18O的物理性质和化学性质完全相同 |
| B、通过化学反应可以实现16O与18O的相互转化 |
| C、向2SO2(g)+O2(g)?2SO3(g)的平衡体系中加入18O2,达到新的平衡后18O只出现在O2与SO3中 |
| D、用惰性电极电解含有H218O的普通水时,阳极可能产生三种相对分子质量不同的氧分子 |
查看答案和解析>>
科目:高中化学 来源: 题型:
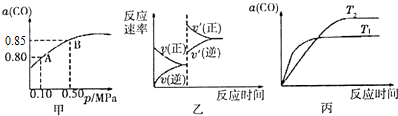
| A、由图甲知,A点CO的平衡浓度为0.4 mol?L-1 |
| B、由图甲知,B点CO、O2、CO2的平衡浓度之比为2:l:2 |
| C、达平衡后,缩小容器容积,则反应速率变化图象可以用图乙表示 |
| D、若0.50 MPa时不同温度下CO转化率与温度关系如丙图,则T2>T1 |
查看答案和解析>>
科目:高中化学 来源: 题型:
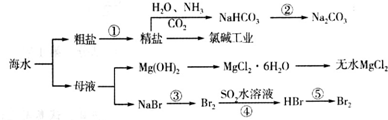
| A、要实现反应②可向NaHCO3溶液中加入过量石灰水 |
| B、溴元素在反应③、⑤中被氧化,在反应④中被还原 |
| C、工业上一般用金属钠与无水MgCl2反应制取Mg单质 |
| D、海水中含有碘元素,可将海水浓缩加热得到碘单质 |
查看答案和解析>>
科目:高中化学 来源: 题型:
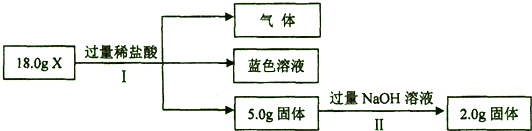
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、0.1mol/L的盐酸和0.1mol/L的氢氧化钠溶液 |
| B、0.1mol/L的盐酸和0.1mol/L的氢氧化钡溶液 |
| C、pH=4的醋酸溶液和pH=10的氢氧化钠溶液 |
| D、pH=4的盐酸和pH=9的氨水 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、金属Mg与稀硫酸和CO2均能反应,其反应类型相同 |
| B、FeCl3、Na2O2、Cu2S均可由相应单质直接化合生成 |
| C、SO2气体通入紫色石蕊试液中,溶液先变红后褪色 |
| D、氢氧化铝、碳酸铵、碳酸氢钠、甘氨酸都既能与盐酸反应,又能与氢氧化钠溶液反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:
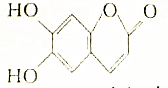 有如图所示的有机物,根据该有机物的结构回答:
有如图所示的有机物,根据该有机物的结构回答:查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com