
 铁及其化合物在日常生活、生产中应用广泛,研究铁及其化合物的应用意义重大.回答下列问题:
铁及其化合物在日常生活、生产中应用广泛,研究铁及其化合物的应用意义重大.回答下列问题:| 温度 | 250℃ | 600℃ | 1000℃ | 2000℃ |
| 主要成分 | Fe2O3 | Fe3O4 | FeO | Fe |
| t/min | 0 | 10 | 20 | 30 | 40 | 50 |
| x(CO) | 0.25 | 0.23 | 0.214 | 0.202 | 0.193 | 0.193 |
分析 (1)根据盖斯定律,将所给的反应②+③×$\frac{2}{3}$可得:Fe2O3(s)+3CO(g)═2Fe(s)+3CO2(g),反应热做相应的变化即可;
(2)根据当1000℃时为FeO,在2000℃时为Fe来分析;设混合物中FeO的物质的量为xmol,Fe的物质的量为ymol,则有:$\frac{x+y}{x}$=$\frac{\frac{35}{56}}{\frac{2}{16}}$,即可求的x:y;
(3)①当一个量,在反应达平衡之前在变化,而后来不变了,则能说明反应达平衡;
②设反应达平衡时CO转化了xmol,根据三段式结合平衡时CO的体积分数来计算;在T℃106Pa时该反应的压强平衡常数Kp=$\frac{P(C{H}_{4})P({H}_{2}O)}{P(CO){P}^{3}({H}_{2})}$来计算;
③反应CO(g)+3H2(g)?CH4(g)+H2O(g)△H<0,温度越高,则平衡左移,CO的平衡转化率越低.
解答 解:(1)已知反应:Fe2O3(s)+$\frac{1}{3}$CO(g)═$\frac{2}{3}$Fe3O4(s)+$\frac{1}{3}$CO2(g)△H2 ②
Fe3O4(s)+4CO(g)═3Fe(s)+4CO2(g)△H3 ③,根据盖斯定律,将所给的反应②+③×$\frac{2}{3}$可得:Fe2O3(s)+3CO(g)═2Fe(s)+3CO2(g),故△H4=△H2+$\frac{2}{3}$△H3 ,故答案为:△H2+$\frac{2}{3}$△H3 ;
(2)根据当1000℃时为FeO,在2000℃时为Fe,故在1600℃时固体物质的主要成分为FeO和Fe的混合物;设混合物中FeO的物质的量为xmol,Fe的物质的量为ymol,则有:$\frac{x+y}{x}$=$\frac{\frac{35}{56}}{\frac{2}{16}}$,即可求的x:y=1:4,故剩余的FeO和被还原为铁的FeO的物质的量之比为1:4,则可知被还原的FeO的百分比为$\frac{4}{1+4}$×100%=80%,
故答案为:FeO和Fe;80%;
(3)①a.由于此容器是个体积可变的容器,故为恒容的容器,则容器内压强一直不变,故不能作为反应达平衡的标志,故a错误;
b.此反应在平衡前,气体的质量不变,但体积变小,故密度变大,故当混合气体的密度不再发生变化时能说明反应达平衡,故b正确;
c.反应达平衡的根本标志是v正=v逆,所以3v正(CO)=v逆(H2),故c错误;
d.在反应达平衡之前,混合气体的质量不变,但物质的量变小,故混合气体的平均相对分子质量在变小,故当不变时能说明反应达平衡,故d正确.
故答案为:bd;
②设反应达平衡时CO转化了xmol,则根据三段式可知:
CO(g)+3H2(g)?CH4(g)+H2O(g)
初始(n):1mol 3mol 0 0
△n:xmol 3xmol xmol xmol
平衡(n):(1-x)mol (3-3x)mol xmol xmol
结合平衡时CO的体积分数为0.193可知:$\frac{1-x}{4-2x}$=0.193,解得x=0.371,故达到平衡时CO的转化率为=$\frac{0.371mol}{1mol}$;
在T℃106Pa时该反应的压强平衡常数Kp=$\frac{P(C{H}_{4})P({H}_{2}O)}{P(CO){P}^{3}({H}_{2})}$=$\frac{(\frac{0,371}{3.258})^{2}}{0.193×(\frac{1.887}{3.258})^{3}×1{0}^{12}P{a}^{2}}$,
故答案为:37.1%;$\frac{(\frac{0,371}{3.258})^{2}}{0.193×(\frac{1.887}{3.258})^{3}×1{0}^{12}P{a}^{2}}$;
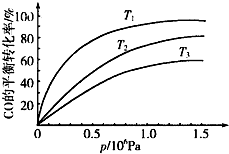
③反应CO(g)+3H2(g)?CH4(g)+H2O(g)△H<0,温度越高,则平衡左移,CO的平衡转化率越低,根据图象可知,温度T3>T2>T1,
故答案为:T3>T2>T1;正反应放热,在相同压强下,温度降低,平衡向正反应方向移动,CO的转化率越高.
点评 本题综合考查了盖斯定律的应用、平衡常数的求算和图象的应用,综合性较强,一直是高考的常见题型,题目难度中等.


科目:高中化学 来源: 题型:解答题
| 温度/℃ | 1 000 | 1 150 | 1 300 |
| 平衡常数 | 64.0 | 50.7 | 42.9 |
| 容器编号 | 起始时各物质物质的量/mol | 达到平衡的时间/min | 达平衡时体系能量的变化/kJ | ||||
| CO | H2O | CO2 | H2 | ||||
| ① | 1 | 4 | 0 | 0 | t1 | 放出热量:32.8 kJ | |
| ② | 2 | 8 | 0 | 0 | t2 | 放出热量:Q | |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 1molFe溶于过量硝酸,电子转移数为2NA | |
| B. | 1mol O2和2mol SO2反应生成的SO3分子数为2NA | |
| C. | 常温常压下,4.4gCO2与N2O混合气体中含有的原子数为0.3NA | |
| D. | H2O2分解产生1molO2,转移的电子数为4NA |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 化学键 | Si-Si | O=O | Si-O |
| 键能/kJ•mol-1 | a | b | c |


查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| t/s c/(mol•L-1) | 0 | 20 | 40 | 60 | 80 | 100 |
| c(N2O4)/(mol•L-1) | 0.100 | c1 | 0.050 | c3 | a | b |
| c(NO2)/(mol•L-1) | 0 | 0.060 | c2 | 0.120 | 0.120 | 0.120 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 温度/℃ | 1000 | 1100 |
| 平衡常数 | 0.68 | 0.50 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 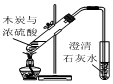 用如图所示装置验证反应产物二氧化碳 | |
| B. | 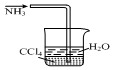 用如图装置吸收氨气并防止倒吸 | |
| C. |  如图装置配制100 mL 1 mol•L-1的硫酸 | |
| D. | 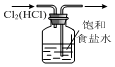 用如图装置除去氯气中的氯化氢 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com