
氮化钠(Na3N)是科学家制备的一种重要化合物,它与水作用可产生NaOH和NH3。请回答下列问题:(1)Na3N的电子式是__________;该化合物是由__________键形成的__________(填“离子”或“共价”)化合物。
(2)Na3N与盐酸反应生成__________种盐,对应的反应方程式是 。
(3)比较Na3N中两种微粒的半径:r(Na+)__________r(N3-)(填“>”“=”“<”符号)。
【考点】本题考查化学键的有关判断、化学方程式的书写,题目难度不大,本题是基础性试题的考查,试题基础性强,注重能力的考查,该题有利于巩固学生对教材基础知识的理解,培养学生的规范答题能力,提高学习效率。
【解析】(1)钠元素和氮元素分别是活泼的金属和活泼的非金属,所以二者形成的化学键是离子键,属于离子化合物,Na3N的电子式为: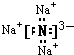 ;
;
(2)氮化钠和水反应生成氨气,则根据原子守恒可判断,另外一种生成物应该是氢氧化钠,所以氮化钠和盐酸反应的生成物应该是氯化钠和氯化铵,共计是2种盐,反应的方程式为Na3N+4HCl==3NaCl+NH4Cl+3H2O;
(3)Na+与N3-属电子层结构相同的粒子,核电荷数越大半径越小,故Na+的核电荷数大而N3-半径小,r(Na+)<r(N3-)。
【答案】(1)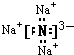 离子 离子(2) 两 Na3N+4HCl==3NaCl+NH4Cl+3H2O
离子 离子(2) 两 Na3N+4HCl==3NaCl+NH4Cl+3H2O
(3)<


科目:高中化学 来源: 题型:
研究人员研制出一种锂水电池,可作为鱼雷和潜艇的储备电源。该电池以金属锂和钢板为电极材 料,以LiOH为电解质,使用时加入水即可放电。关于该电池的下列说法不正确的是( )
料,以LiOH为电解质,使用时加入水即可放电。关于该电池的下列说法不正确的是( )
A.水既是氧化剂又是溶剂
B.放电时正极上有氢气生成
C.放电时OH-向正极移动
D.总反应为:2Li +2H2O===2LiOH+H2↑
查看答案和解析>>
科目:高中化学 来源: 题型:
在5L的密闭容器中进行下述反应 ,30S内,NO增加了0.3mol,则在30S内,该反应的平均反应速率正确的是
,30S内,NO增加了0.3mol,则在30S内,该反应的平均反应速率正确的是
A.V(O2 )=0.01mol·L-1·s-1 B. V(NO )=0.08mol·L-1·s-1
C. V(H2O)=0.01mol·L-1·s-1 D. V(NH3)=0.002mol·L-1·s-1
查看答案和解析>>
科目:高中化学 来源: 题型:
三氧化二镍(Ni2O3)可用于制造高能电池,其电解法制备过程如下:用NaOH调NiCl2溶液pH至7.5,再加入适量硫酸钠后进行电解。电解过程中产生的Cl2在弱碱性条件下生成ClO-,把二价镍氧化为三价镍。以下说法不正确的是
A.可用铁作阳极材料
B.电解过程中阳极附近溶液的pH降低
C.阳极反应方程式为:2Cl--2e-=Cl2
D.1 mol二价镍全部转化为三价镍时,外电路中通过了1 mol电子
查看答案和解析>>
科目:高中化学 来源: 题型:
1)工业品氢氧化钾的溶液中含有某些含氧酸根杂质,可用离子交换膜法电解提纯。电解槽内装有离子交换膜【阴(阳)离子交换膜只允许阴(阳)离子通过】,其工作原理如图所示。

①该电解槽的阳极反应式是 。
②图中a、b两处分别加入的物质是 、 ;离子交换膜为 (填“阴”或“阳”)离子交换膜。
③除去杂质后氢氧化钾溶液从液体出口 (填写“A”或“B”)导出。
(2)海洋资源的开发与利用具有广阔的前景,海水中锂元素储量非常丰富,从海水中提取锂的研究极具潜力。锂是制造化学电源的重要原料,如LiFePO4电池某电极的工作原理如下图所示:
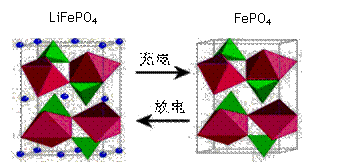
该电池电解质为能传导 Li+的固体材料。放电时该电极是电池的 极(填“正”或“负”),电极反应式为 。
(3)利用海洋资源可获得MnO2 。MnO2可用来制备高锰酸钾:将MnO2与KOH混合后在空气中加热熔融,得到绿色的锰酸钾(K2MnO4),再利用氯气将锰酸钾氧化成高锰酸钾。该制备过程中消耗相同条件下空气和氯气的体积比为___________________(空气中氧气的体积分数按20%计)。
(4)海水中也含有大量的镁元素,高温时,用CO还原MgSO4可制备高纯MgO。
①750℃时,测得气体中含等物质的量SO2和SO3,此时反应的化学方程式是:
。
②由MgO可制成“镁—次氯酸盐”燃料电池,其装置示意图如下图,该电池反应的总离子方程式为 。

查看答案和解析>>
科目:高中化学 来源: 题型:
下列针对甲、乙、丙、丁四种实验及装置的说法,不合理的是
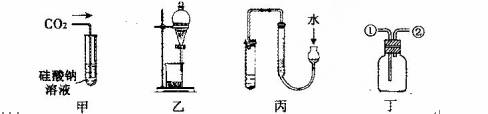
A.甲可用证明碳的非金属性比硅强
B.乙装置可用于碘水中碘的萃取及分液
C.用丙图示的方法检查此装置的气密性
D.丁装置:从①进气可收集NO;从②进气可收集NH3
查看答案和解析>>
科目:高中化学 来源: 题型:
将Na2O2逐渐加入到含有Al3+、Mg2+、NH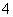 的混合液中并微热,产生沉淀和气体的物质的量与加入Na2O2的物质的量的关系如下图所示,则原混合液中Al3+、Mg2+、NH
的混合液中并微热,产生沉淀和气体的物质的量与加入Na2O2的物质的量的关系如下图所示,则原混合液中Al3+、Mg2+、NH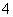
 的物质的量分别是
的物质的量分别是
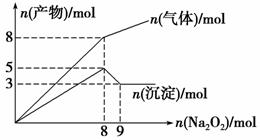
A.2 mol、3 mol、4 mol B.2 mol、3 mol、8 mol
C.3 mol、2 mol、8 mol D.3 mol、2 mol、4 mol
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com