
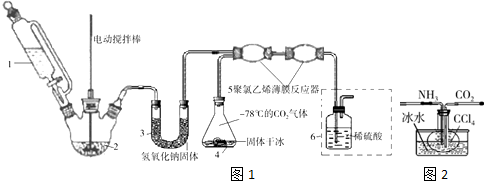
分析 (1)三颈烧瓶内制备氨气,反应由液体与固体不加热制备氨气,可以是浓氨水与碱制备,由于氨基甲酸铵易水解,U型管内氢氧化钠干燥氨气,在5中反应得到氨基甲酸铵,6中稀硫酸进行尾气处理;
(2)若反应初期观察到装置内稀硫酸溶液中产生气泡,说明有二氧化碳排出,通入氨气的量不足;
(3)①氨基甲酸铵受热分解成尿素CO(NH2)2,由原子守恒可知还生成水;
②氨基甲酸铵受热易分解,采取减压低温烘干;
(4)有利于产品收集,氨基甲酸铵受热易分解,且生成氨基甲酸铵的反应为放热反应;
(5)样品中碳元素全部转化为碳酸钙,根据碳原子守恒、混合物总质量列方程计算.
解答 解:(1)三颈烧瓶内制备氨气,反应由液体与固体不加热制备氨气,可以是浓氨水与碱制备,由于氨基甲酸铵易水解,U型管内氢氧化钠干燥氨气,在5中反应得到氨基甲酸铵,6中稀硫酸进行尾气处理,
故答案为:浓氨水;U型管;干燥氨气;
(2)若反应初期观察到装置内稀硫酸溶液中产生气泡,说明有二氧化碳排出,通入氨气的量不足,应该适当加快产生氨气的流速,
故答案为:加快;
(3)①氨基甲酸铵受热分解成尿素CO(NH2)2,由原子守恒可知还生成水,反应方程式为:NH2COONH4$\frac{\underline{\;\;△\;\;}}{\;}$CO(NH2)2+H2O,
故答案为:NH2COONH4$\frac{\underline{\;\;△\;\;}}{\;}$CO(NH2)2+H2O;
②氨基甲酸铵受热易分解,采取减压低温烘干,即真空微热烘于,
故答案为:D;
(4)用玻璃烧瓶做反应器,内壁容易形成致密坚硬、粘附能力强的产物结晶体,不利于产品收集,不利于内壁影响散热,合成H2NCOONH4的反应为放热反应,温度过高不利于H2NCOONH4的生成,改用聚氯乙烯薄膜材料的反应器,可以避免上述情况,
故选:AB;
(5)样品中碳元素全部转化为碳酸钙,碳酸钙的物质的量为$\frac{1.5g}{100g/mol}$=0.015mol,设氨基甲酸铵、碳酸氢铵的物质的量分别为xmol、ymol,
根据碳原子守恒,则x+y=0.015
根据总质量可知,则78x+79y=1.173
解得x=0.012,y=0.003
0.012mol×78g/mol=0.936g,
样品中氨基甲酸铵的质量分数=$\frac{0.936g}{1.173g}$×100%=79.8%,
故答案为:79.8%
点评 本题考查物质制备实验、物质的分离提纯、对装置的分析评价、对信息的获取与迁移应用、化学计算等,(5)中计算为易错点,关键是注意碳元素全部转化为碳酸钙,需要学生具备扎实的基础与灵活应用能力,题目难度中等.


 学而优衔接教材南京大学出版社系列答案
学而优衔接教材南京大学出版社系列答案科目:高中化学 来源: 题型:选择题
| A. | 3.6g | B. | 1.8g | C. | 7.2g | D. | 4.8g |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 ),有关反应、数据和实验步骤如下:
),有关反应、数据和实验步骤如下:
| 熔点/℃ | 沸点/℃ | 颜色 | 水溶性 | 相对分子质量 | |
| 对氯甲苯 | 7.5 | 162 | 无色 | 难溶 | 126.5 |
| 对氯苯甲酸 | 243 | 275 | 白色 | 微溶 | 156.5 |
| 对氯苯甲酸钾 | 具有盐的通性,属于可溶性盐 | ||||
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | CH3CHO+H2$\stackrel{Ni}{→}$CH3CH2OH | |
| B. | CH3CHO+2Ag(NH3)2OH$\stackrel{△}{→}$CH3COONH4+2Ag↓+3NH3+H2O | |
| C. | CH3CHO+2Cu(OH)2+NaOH$\stackrel{△}{→}$CH3COONa+Cu2O↓+3H2O | |
| D. | 2CH3CHO+O2$\stackrel{△}{→}$2CH3COOH |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 纯水不导电,所以水不是电解质 | |
| B. | SO3水溶液的导电性很强,所以SO3是电解质 | |
| C. | 液态的铜导电性很好,所以铜是电解质 | |
| D. | Na2O液态时能导电,所以Na2O是电解质 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 实验事实 | 结论 | |
| A | A元素的原子半径比B元素的原子半径大 | 周期表中A位于B的下一周期 |
| B | 将CO2通入到Na2SiO3溶液中产生白色浑浊 | 酸性:H2CO3>H2SiO3 |
| C | 常温下,铜能与浓硝酸反应而铝被浓硝酸钝化 | 还原性:Cu>Al |
| D | 常温下白磷可自燃而氮气须在放电时才与氧气反应 | 非金属性:P>N |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 ,B
,B ,C
,C ,D
,D .它们离子的半径由大到小的顺序r(S2-)>r(Cl-)>r(K+)>r(Ca2+).
.它们离子的半径由大到小的顺序r(S2-)>r(Cl-)>r(K+)>r(Ca2+).查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com