
分析 短周期中,氯气为黄绿色气体、F2浅黄色气体,Na原子半径最大,H原子半径最小,F的非金属性最强,Na的金属性最强,F无正价,Cl的最高正极为+7价,氨水显碱性,地壳中含量最多的元素为O,以此来解答.
解答 解:在短周期元素中,(均用化学符号表示)
(1)常温下有颜色的气体单质有Cl2、F2,故答案为:Cl2、F2;
(2)除稀有气体外,原子半径最大的元素是Na;最小的元素是H,故答案为:Na;H;
(3)气态氢化物中最稳定的是HF,其水溶液呈碱性的元素是NH3,故答案为:HF;NH3;
(4)在最高价氧化物中呈最高正价的元素是Cl,故答案为:Cl;
(5)地壳中含量最多的元素为O,故答案为:O.
点评 本题考查元素周期表的结构与应用,为高频考点,把握元素的位置、元素的性质、元素化合物知识等为解答的关键,侧重分析与应用能力的考查,题目难度不大.


 全能测控期末小状元系列答案
全能测控期末小状元系列答案科目:高中化学 来源: 题型:解答题

| 金属离子 | Fe3+ | Cu2+ |
| 氢氧化物开始沉淀时的pH | 1.9 | 4.7 |
| 氢氧化物完全沉淀时的pH | 3.2 | 6.7 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
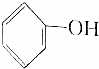 >HCO3-,下列化学方程式不正确的是( )
>HCO3-,下列化学方程式不正确的是( )| A. | 2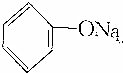 +H2O+CO2→2 +H2O+CO2→2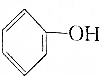 +Na2CO3 +Na2CO3 | B. | 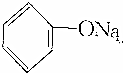 +H2O+CO2→ +H2O+CO2→ +NaHCO3 +NaHCO3 | ||
| C. |  +Na2CO3→ +Na2CO3→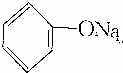 +NaHCO3 +NaHCO3 | D. | 2 +2Na→2 +2Na→2 +H2↑ +H2↑ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
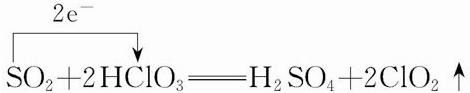 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 全部 | B. | ②③④⑤⑥⑦ | C. | ②③④⑤⑦ | D. | 只有③④⑤⑥⑦ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
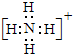
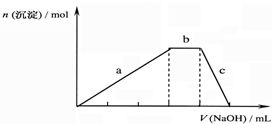
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 吸收92KJ | B. | 放出92kJ | C. | 吸收184kJ | D. | 放出184KJ |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com