
【题目】有效去除大气中的NOx,保护臭氧层,是环境保护的重要课题。
(1)在没有NOx催化时,O3的分解可分为以下两步反应进行;
①O3=O+O2 (慢) ②O+O3=2O2 (快)
第一步的速率方程为v1=k1c(O3),第二步的速率方程为v2=k2c(O3)·c(O)。其中O为活性氧原子,它在第一步慢反应中生成,然后又很快的在第二步反应中消耗,因此,我们可以认为活性氧原子变化的速率为零。请用k1、k2组成的代数式表示c(O)=____________。
(2)NO做催化剂可以加速臭氧反应,其反应过程如图所示:
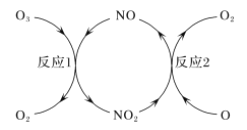
已知:O3(g)+O(g)=2O2(g) ΔH=-143 kJ/mol
反应1:O3(g)+NO(g)=NO2(g)+O2(g) ΔH1=-200.2 kJ/mol。
反应2:热化学方程式为____________________________。
(3)一定条件下,将一定浓度NOx(NO2和NO的混合气体)通入Ca(OH)2悬浊液中,改变![]() ,NOx的去除率如图所示。
,NOx的去除率如图所示。
已知:NO与Ca(OH)2不反应;

NOx的去除率=1-![]() ×100%
×100%
①![]() 在0.3-0.5之间,NO吸收时发生的主要反应的离子方程式为:___________。
在0.3-0.5之间,NO吸收时发生的主要反应的离子方程式为:___________。
②当![]() 大于1.4时,NO2去除率升高,但NO去除率却降低。其可能的原因是__________。
大于1.4时,NO2去除率升高,但NO去除率却降低。其可能的原因是__________。
(4)若将CO和NO按不同比例投入一密闭容器中发生反应:2CO(g)+2NO(g)=N2(g)+2CO2(g) ΔH=-759.8 kJ/mol,反应达到平衡时,N2的体积分数随![]() 的变化曲线如图。
的变化曲线如图。
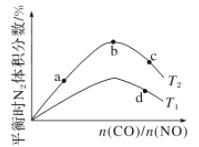
①b点时,平衡体系中C、N原子个数之比接近________。
②a、b、c三点CO的转化率从小到大的顺序为________;b、c、d三点的平衡常数从大到小的顺序为__________(以上两空均用a、b、c、d表示)。
③若![]() =0.8,反应达平衡时,N2的体积分数为20%,则NO的转化率为_____。
=0.8,反应达平衡时,N2的体积分数为20%,则NO的转化率为_____。
【答案】![]() NO2(g)+O(g)=NO(g)+O2(g) △H2=+57.2kJ/mol NO+NO2+Ca(OH)2=Ca2++2NO2-+H2O NO2量太多,剩余的NO2和水反应生成NO逸出,导致NO去除率降低 1:1 c<b<a b=c>d 60%
NO2(g)+O(g)=NO(g)+O2(g) △H2=+57.2kJ/mol NO+NO2+Ca(OH)2=Ca2++2NO2-+H2O NO2量太多,剩余的NO2和水反应生成NO逸出,导致NO去除率降低 1:1 c<b<a b=c>d 60%
【解析】
(1)由于活性氧原子变化的速率为零,可认为其生成速率等于消耗速率,以此计算即可;
(2)根据盖斯定律将两个热化学反应相减可得到反应2的热化学方程式;
(3)①NO、NO2和Ca(OH)2发生归中反应产生Ca(NO2)2、H2O;
②根据二者发生归中反应的物质的量的比及NO2与水反应产生HNO3和NO分析判断;
(4)①b点时N2含量最高,说明按方程式计量关系反应,根据方程式分析C、N个数的比;
②根据坐标系中横坐标的含义及物质浓度与物质转化率的关系分析判断。利用化学平衡常数与温度的关系及该反应的正反应为放热反应,利用温度对平衡移动的影响判断;
③根据物质反应转化关系,结合![]() =0.8,反应达平衡时,N2的体积分数为20%,计算平衡时各种物质的浓度,最后根据转化率的含义计算NO的转化率。
=0.8,反应达平衡时,N2的体积分数为20%,计算平衡时各种物质的浓度,最后根据转化率的含义计算NO的转化率。
(1)由于活性氧原子变化的速率为零,可认为其生成速率等于消耗速率,v1=k1c(O3), v2=k2c(O3)·c(O),则k1c(O3)=k2c(O3)·c(O),所以c(O)=![]() ;
;
(2)反应①是O3在NO作用下生成NO2和O2,NO2在氧原子作用下生成NO和O2,反应过程中NO参与反应后又生成,所以NO作用为催化剂,根据盖斯定律将两个热化学反应相减可得到反应2的热化学方程式;NO2(g)+O(g)=NO(g)+O2(g) △H=+57.2 kJ/mol;
(3)①NO和Ca(OH)2不反应,所以反应物有NO、NO2和Ca(OH)2,根据氧化还原规律,产物为Ca(NO2)2和水,所以离子方程式为:NO+NO2+Ca(OH)2=Ca2++2NO2-+H2O;
②当NO太少,NO2量太多,首先发生反应:NO+NO2+Ca(OH)2=Ca2++2NO2-+H2O;NO2不能完全吸收,过量的NO2就和水反应生成HNO3和NO,这样就导致NO2去除率升高,但NO去除率却降低;
(4)①当反应物按化学计量数之比加入时,平衡时的N2的体积分数最大,所以b点的平衡体系中C、N原子个数比接近1:1;
②增大![]() ,CO的浓度增大的倍数大于NO增大的倍数,使CO转化率降低,所以a、b、c三点CO的转化率从小到大的顺序为c<b<a;由于化学平衡常数只与温度有关,所以b、c点的平衡常数相同,该反应的正反应为放热反应,升高温度,化学平衡逆向移动,N2的体积分数减小,所以T1>T2,平衡逆向移动,化学平衡常数减小,故d点平衡常数小于b、c点,所以b、c、d三点的平衡常数从大到小的顺序为b=c>d;
,CO的浓度增大的倍数大于NO增大的倍数,使CO转化率降低,所以a、b、c三点CO的转化率从小到大的顺序为c<b<a;由于化学平衡常数只与温度有关,所以b、c点的平衡常数相同,该反应的正反应为放热反应,升高温度,化学平衡逆向移动,N2的体积分数减小,所以T1>T2,平衡逆向移动,化学平衡常数减小,故d点平衡常数小于b、c点,所以b、c、d三点的平衡常数从大到小的顺序为b=c>d;
③若![]() =0.8,反应达平衡时,N2的体积分数为20%,假设开始时n(NO)=1 mol,n(CO)=0.8 mol,假设CO平衡时CO转化了x mol,则根据物质反应转化关系可知平衡产生CO2的物质的量为x mol,N2为0.5x mol,则此时CO为(0.8-x) mol,NO为(1-x) mol,
=0.8,反应达平衡时,N2的体积分数为20%,假设开始时n(NO)=1 mol,n(CO)=0.8 mol,假设CO平衡时CO转化了x mol,则根据物质反应转化关系可知平衡产生CO2的物质的量为x mol,N2为0.5x mol,则此时CO为(0.8-x) mol,NO为(1-x) mol,![]() ×100%=20%, 解得x=0.6 mol,所以NO的转化率为
×100%=20%, 解得x=0.6 mol,所以NO的转化率为![]() ×100%=60%。
×100%=60%。


 A加金题 系列答案
A加金题 系列答案 全优测试卷系列答案
全优测试卷系列答案科目:高中化学 来源: 题型:
【题目】有机物E(C11H12O2) 属于芳香酯类物质,天然物存在于威士忌酒、苹果酒等中,呈水果及玫瑰香气,可由下列路线人工合成:

完成下列填空:
(1)A中官能团的名称是________________;C物质的结构简式是________________。
(2)反应③的条件是_______________;反应④的类型是_____________________。
(3)写出反应⑥的化学方程式:__________________________________________________________________。
(4)如何检验反应②中的A是否完全转化?__________________________________________________________________。
(5)设计一条由![]() 出发,制备
出发,制备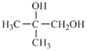 的合成路线(合成路线常用的表示方式为:
的合成路线(合成路线常用的表示方式为: )______________________________。
)______________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】科学家艾哈迈德·泽维尔使“运用激光技术观测化学反应时原子的运动”成为可能。泽维尔研究发现,当激光脉冲照射NaI时,Na+和I—两核间距在10~15![]() (埃,1
(埃,1![]() =1×10-10m),呈现离子键;当两核靠近约2.8
=1×10-10m),呈现离子键;当两核靠近约2.8![]() 时,呈现共价键。根据泽维尔的研究成果能得出的结论是( )
时,呈现共价键。根据泽维尔的研究成果能得出的结论是( )
A. NaI晶体是离子晶体和分子晶体的混合物
B. 共价键和离子键没有明显的界限
C. NaI晶体中既有离子键,又有共价键
D. 离子晶体可能含有共价键
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)5.4 g H2O的物质的量是_____,含有_________个水分子(用NA表示),含有____mol H。
(2)11.2L NH3(标况)约含_____ mol氢原子,_____ g的氮原子。
(3)6.02×1022个OH 的质量为____,含有质子的物质的量为_____,含有电子的物质的量为__ 。
(4)12.4 g Na2R含Na+0.4 mol,则Na2R的摩尔质量为_______,R的相对原子质量为_______。含R的质量为1.6 g的Na2R,其物质的量为________。
(5)物质的量相同的CO2和O2,其所含原子数目之比为_____,所含氧原子数目之比为______;质量相同的CO2和O2,其物质的量之比为_________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】短周期元素W、X、Y、Z在元素周期表中的相对位置如表所示,其中W元素的原子最外层电子数是内层电子数的2倍。下列说法正确的是
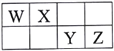
A. 原子半径大小:Z>Y>X
B. 最高价氧化物对应水化物的酸性:W>Y>Z
C. Y单质具有杀菌能力,Y与W可形成化合物WY2
D. W元素和氢元素形成的化合物可与Z单质反应,但不能与Z的氢化物反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用含钴废料(主要成分为Co,含有一定量的Ni、Al2O3、Fe、SiO2等)制备草酸钴晶体(CoC2O42H2O)的工业流程如图。已知:①草酸钴晶体难溶于水,②RH为有机物(难电离)
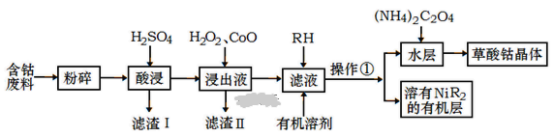
(1)滤渣I的主要成分是_____________(填化学式) ,写出两种能提高酸浸速率的措施_____________ 、 ___________。
(2) 操作①用到的主要仪器有___________________。
(3) H2O2是种绿色氧化剂,写出加入H2O2后发生反应的离子方程式________________________________________。
(4)加入氧化钴的目的是______________________________。
(5)加入(NH4)2C2O4反应得到草酸钴晶体的离子方程式________________________________,过滤得到的草酸钴晶体需要用蒸馏水洗涤,检验是否洗涤干净的方法是__________________________________________。
(6)实验室可以用酸性KMnO4标准液滴定草酸根离子(C2O42-) ,测定溶液中C2O42-的浓度, KMnO4标准溶液常用硫酸酸化,若用盐酸酸化,会使测定结果___________(填“偏高”、“偏低“或“无影响”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】对可逆反应2A(s)+3B(g) ![]() C(g)+2D(g) ΔH<0,在一定条件下达到平衡,下列有关叙述正确的是( )
C(g)+2D(g) ΔH<0,在一定条件下达到平衡,下列有关叙述正确的是( )
①增加A的量,平衡向正反应方向移动
②升高温度,平衡向逆反应方向移动,v(正)减小
③压强增大一倍,平衡不移动,v(正)、v(逆)不变
④增大B的浓度,v(正)>v(逆)
⑤加入催化剂,B的转化率提高
A.①②B.④C.③D.④⑤
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某研究小组拟合成染料X和医药中间体Y。

已知:
![]()
CH3CH2Cl![]() CH3CH2CNCH3CH2COOH
CH3CH2CNCH3CH2COOH
(1)下列说法正确的是______
A.化合物A能与FeCl3溶液发生显色反应B.化合物E具有弱碱性
C.化合物X能发生加成、取代、还原反应
D.化合物Y的分子式为C20H23NO4
(2)化合物C的结构简式______
(3)写出D+E→X的化学反应方程式______
(4)写出同时符合下列条件的B的同分异构体的结构简式______
1H-NMR谱和IR谱检测表明:
①分子中有4种化学环境不同的氢原子;
②分子中含有苯环、甲氧基(-OCH3),-CH2Cl
(5)请设计以苯和乙烯为原料制备 的合成路线(用流程图表示,无机试剂任选)。合成路线流程图示例如下:CH3CH2OHCH3CHOCH3COOH______________
的合成路线(用流程图表示,无机试剂任选)。合成路线流程图示例如下:CH3CH2OHCH3CHOCH3COOH______________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】青铜(Cu-Zn)是我国最早大量使用的合金,其中锌是现代工业上常用金属。某废催化剂含58.2%的SiO2(不溶于水和稀酸)、21.0%的ZnO、4.5%的ZnS(不溶于水但溶于稀酸)和12.8%的CuS(不溶于水也不溶于稀酸)。某同学用15.0 g该废催化剂为原料,以稀硫酸和H2O2为试剂,回收其中的锌和铜。
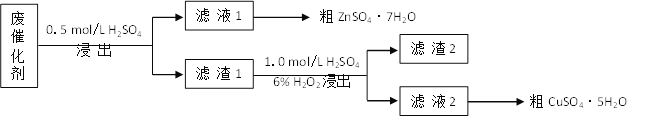
(1)第一次浸出时发生的反应化学方程式是__________。
(2)滤渣2是__,第二次浸出发生的反应离子方程式是________。
(3)从滤液1、滤液2中分别得到粗ZnSO4·7H2O、粗CuSO4·5H2O的操作均是____、过滤、洗涤、干燥。
(4)某同学在实验完成之后,得到1.5gCuSO4·5H2O(M=250 g·mol–1),则铜的回收率为_____。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com