
分析 元素X最高价氧化物的化学式为X2O5,则X为第ⅤA族元素,前四周期的A、B、C、D均与元素X紧密相邻,即位于X的四周,则A、B、C、D位于元素周期表的第二、三、四周期,X为磷元素,B、D同主族且B元素的原子半径是同族元素中最小的,B、X、D同主族,则B为氮元素,D为砷元素,C的最高价氧化物对应的水化物是强酸,C为硫元素,A为硅元素,F元素基态原子M层上有5对成对电子,则F的核外电子排布式为1s22s22p63s23p63d64s2,所以F为铁元素,以此解答该题.
解答 解:元素X最高价氧化物的化学式为X2O5,则X为第ⅤA族元素,前四周期的A、B、C、D均与元素X紧密相邻,即位于X的四周,则A、B、C、D位于元素周期表的第二、三、四周期,X为磷元素,B、D同主族且B元素的原子半径是同族元素中最小的,B、X、D同主族,则B为氮元素,D为砷元素,C的最高价氧化物对应的水化物是强酸,C为硫元素,A为硅元素,F元素基态原子M层上有5对成对电子,则F的核外电子排布式为1s22s22p63s23p63d64s2,所以F为铁元素,
(1)D是砷元素,原子序数为33,其基态原子的电子排布式为1s22s22p63s23p63d104s24p3,价电子排布式为3d104s24p3,故答案为:4s24p3;
(2)B、X、D氢化物分别为NH3、PH3、AsH3,因为氨分子之间有氢键的存在,所以氨的沸点较大,则AsH3>的相对分子质量大于PH3,所以沸点也高于PH3,所以它们的沸点由高到低的顺序为NH3>AsH3>PH3,故答案为:NH3>AsH3>PH3;
(3)EO3-为ClO3-,中心原子氯原子的价层电子对数均为$\frac{7+1}{2}$=4,所以氯原子都是sp3杂化,在ClO3-中有三个Cl-O键,有1个孤电子对,所以ClO3-的空间构型为三角锥形,
故答案为:三角锥形;
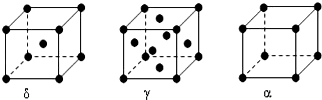
(4)F元素基态原子M层上有5对成对电子,应为FE元素,δ晶胞中,以顶点Fe原子研究,与之最近的Fe原子处于晶胞的体心,补全晶胞可知配位数为8,γ晶胞中,以顶点Fe原子研究,与之最近的Fe原子处于面心上,补全晶胞可知,有3层,每层有4个,故Fe原子的配位数为4×3=12.α晶胞中,以顶点Fe原子研究,与之最近的Fe原子处于所在棱的顶点上,补全晶胞可知配位数为6,所以δ、γ、α三种晶胞中Fe原子的配位数之比为4:6:3;设铁原子的直径为a,根据晶胞结构图可知,δ晶胞的边长为$\frac{2a}{\sqrt{3}}$、γ晶胞的边长为$\frac{2a}{\sqrt{2}}$、α晶胞的边长为a,含有的Fe原子个数分别为1+8×$\frac{1}{8}$=2、8×$\frac{1}{8}$+6×$\frac{1}{2}$=4、8×$\frac{1}{8}$=1,所以δ、γ、α三种晶胞的密度之比为$\frac{2}{(\frac{2a}{\sqrt{3}})^{3}}$:$\frac{4}{(\frac{2a}{\sqrt{2}})^{3}}$:$\frac{1}{{a}^{3}}$=
=34:37:26,
故答案为:铁;4:6:3;34:37:26.
点评 本题考查物质结构和性质,为高频考点,涉及晶胞计算、原子杂化方式判断、微粒空间构型判断等知识点,侧重考查学生分析计算及空间想象能力,注意晶胞中每个原子被几个晶胞共用,为易错点.


科目:高中化学 来源: 题型:解答题
| 温度 | K |
| 973K | 1.47 |
| 1173K | 2.15 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 0.3 mol•L-1 的NH4NO3溶液中含有的NO-3数目为0.3NA | |
| B. | 常温常压下,5.6gC2H4和C3H6的混合气体中含氢原子数为0.9NA | |
| C. | 将标准状况下11.2L的Cl2通入足量水中,转移的电子总数为0.5NA | |
| D. | 一定量的Fe与含1 mol HNO3的稀硝酸恰好反应,则被还原的氮原子数小于NA |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | HCl和NaOH反应的中和热△H=-57.3 kJ/mol,则H2SO4和Ca(OH)2反应的反应热△H=2×(-57.3)kJ/mol | |
| B. | CO(g)的燃烧热是283.0 kJ/mol,则2CO2(g)═2CO(g)+O2(g)反应的△H=+566.0 kJ/mol | |
| C. | 需要加热才能发生的反应一定是吸热反应 | |
| D. | 1 mol甲烷燃烧生成气态水和二氧化碳所放出的热量是甲烷的燃烧热 |
查看答案和解析>>
科目:高中化学 来源: 题型:推断题
 已知X的电负性在同主族元素中最大,其基态原子最外电子层的p轨道呈半充满状态.回答下列问题:
已知X的电负性在同主族元素中最大,其基态原子最外电子层的p轨道呈半充满状态.回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 含等物质的量的MgCl2、Ba(OH)2、HNO3三种溶液混合:Mg2++2OH-═Mg(OH)2↓ | |
| B. | CaCO3溶于CH3COOH:CaCO3+2H+═Ca2++CO2↑+H2O | |
| C. | 过量HI溶液加入到Fe(NO3)3溶液中:2Fe3++2I-═2Fe2++I2 | |
| D. | 向NaClO溶液中通入少量SO2:3ClO-+SO2+H2O═2HClO+SO42-+Cl- |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 都由C和H两种元素组成 | B. | 都能使酸性KMnO4溶液褪色 | ||
| C. | 都能发生加成反应和取代反应 | D. | 都能使溴水褪色 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①② | B. | ①③ | C. | ②③ | D. | ③④ |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com