
分析 我国化工专家侯德榜发明了“联合制碱法”,其生产过程中发生的反应主要是:
①NH3+CO2+H2O═NH4HCO3
②NH4HCO3+NaCl═NaHCO3↓+NH4Cl
③2NaHCO3 $\frac{\underline{\;\;△\;\;}}{\;}$Na2CO3+H2O+CO2↑
解答 解:由侯氏制碱原理:NH3+CO2+H2O+NaCl═NaHCO3↓+NH4Cl和2NaHCO3 $\frac{\underline{\;\;△\;\;}}{\;}$Na2CO3+H2O+CO2↑,最终的化工产品是Na2CO3、NH4Cl,
故答案为:Na2CO3、NH4Cl.
点评 本题主要让学生了解化学的发展历史,关注化学学科成就,有利于激发学习化学的兴趣,培养学生的社会责任感.


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:解答题
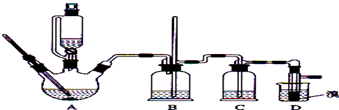
| 乙醇 | 1,2-二溴乙烷 | 乙醚 | |
| 状态 | 无色液体 | 无色液体 | 无色液体 |
| 密度/g•cm-3 | 0.79 | 2.2 | 0.71 |
| 沸点/℃ | 78.5 | 132 | 34.6 |
| 熔点/℃ | 一l30 | 9 | -1l6 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 缩小容器体积,NO2体积分数减小,混合气体颜色变浅 | |
| B. | 保持容器体积不变,加入少许NO2,重新达到平衡时,NO2的体积分数增大 | |
| C. | 保持容器体积不变,加入少许N2O4再达到平衡时,气体颜色变深 | |
| D. | 保持容器体积不变,加入少许NO2,将使正反应速率减小 |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 混合气体的密度不随时间变化而变化 | |
| B. | 3v正(B)=v逆(D) | |
| C. | D的物质的量分数在混合气体中保持不变 | |
| D. | B、C、D的分子个数之比为3:2:1 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
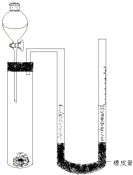 在化学研究领域,经常需要对一些物质进行性质的确定.如利用下列装置(夹持仪器已略去)测出一定质量镁与盐酸反应放出的气体体积,对金属镁的相对原子质量进行测定,实验步骤如下:
在化学研究领域,经常需要对一些物质进行性质的确定.如利用下列装置(夹持仪器已略去)测出一定质量镁与盐酸反应放出的气体体积,对金属镁的相对原子质量进行测定,实验步骤如下:查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 加入BaCl2溶液,产生了白色沉淀.则溶液中一定含有SO42- | |
| B. | 加入BaCl2溶液产生了白色沉淀,再加盐酸,沉淀不消失,则溶液中一定含有SO42- | |
| C. | 加入盐酸酸化的氯化钡溶液,产生白色沉淀,则溶液中一定有SO42- | |
| D. | 加入盐酸,溶液无明显现象,再加BaCl2溶液,产生了白色沉淀.则溶液中一定含有SO42- |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com