
A.A=1×10-4B B.B=1×10-4A C.A>B D.A=B
 字词句篇与同步作文达标系列答案
字词句篇与同步作文达标系列答案科目:高中化学 来源: 题型:
| 难溶电解质 | AgI | AgOH | Ag2S | PbI2 | Pb(OH)2 | PbS |
| Ksp | 8.3×10-12 | 5.6×10-8 | 6.3×10-50 | 7.1×10-9 | 1.2×10-15 | 3.4×10-28 |
查看答案和解析>>
科目:高中化学 来源: 题型:
(1)室温时氢氧化钙的溶度积KSP =4.7×10-6, 室温时将9 mL0.02 mol·L—1的氯化钙溶液与1 mL
pH=13的氢氧化钠溶液混合后(溶液体积可直接加和),溶液中 沉淀析出(填有或无).
(2)2.24升(标准状态)氨气通入250mL 浓度为0.1 mol·L—1的硫酸溶液中,充分反应后溶液中各离子浓度大小为 (按由大到小的顺序写出各离子符号)
(3) 人体血液含Ca2+。现抽取某人血样10 mL,稀释后用草酸铵[(NH4)2C2O4]溶液处理,使Ca2+完全转变为草酸钙(CaC2O4)沉淀;过滤,洗涤,将得到的沉淀用稀硫酸溶解得到草酸(H2C2O4)溶液,用5.0×10-3 mol·L-1 KMnO4溶液滴定得到的草酸至终点,共耗去2.0 mL KMnO4溶液。由上述实验数据可求得此人血液中Ca2+的物质的量浓度为 .(提示:2 KMnO4 + 5H2C2O4 + 3H2SO4 = 2MnSO4 + K2SO4 + 10CO2↑+8H2O)
(4)用下图完成相应实验.

①断开K1,闭合K2接通直流电源,写出阳极 的电极反应 .
电解的总反应方程式
②电解一段时间后,当两石墨棒均有气体包围时,切断K2闭合K1,发现电路中有电流通过. 写出a极的电极反应式
查看答案和解析>>
科目:高中化学 来源:2012届福建省三明市普通高中高三上学期联合命题考试化学试卷 题型:填空题
(10分)(1)常温下,某水溶液M中存在的离子有:Na+、A2-、HA-、H+、OH-,存在的分子有H2O、H2A。根据题意回答下列问题:
①写出酸H2A的电离方程式__________________________。
②若溶液M由2 mol·L-1NaHA溶液与2mol·L-1NaOH溶液等体积混合而得,则溶液M的pH ____7 (填“>”、“<”或“=”);溶液M中各微粒的浓度关系正确的是 。
A.c(Na+)>c(A2-)>c(OH-) >c(H+)
B. c(HA-) +c(H2A) +c(H+)=c(OH-)
C.c(A2-)+c(HA-) +c(H2A)=1 mol·L-1
D. c(A2-)+c(HA-)+c(OH-)=c(Na+)+c(H+)
(2)室温时,氢氧化钙的溶度积KSP =4.7×10-6, 室温时将9 mL0.02 mol·L—1的氯化钙溶液与1 mL pH=13的氢氧化钠溶液混合后(溶液体积可直接加和),溶液中___ 沉淀析出(填“有”或“无”)。
(3) 某校课外活动小组为测定已部分脱水的生石膏的组成(xCaSO4·yH2O),做如下实验:将固体加热,经测量剩余固体质量随时间变化如图所示。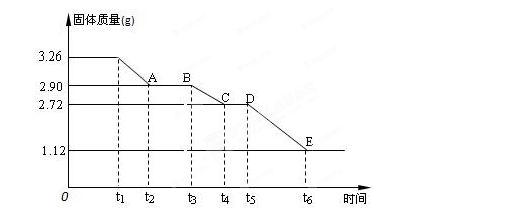
则x:y= 。t2~t3时间段固体的化学式为 。t5~t6时间段固体质量减轻的原因是产生了两种气体,其中一种能使品红溶液褪色。则该时间所发生反应的化学方程式为 。
查看答案和解析>>
科目:高中化学 来源:2011-2012学年福建省高三第一学期联合命题考试化学试卷 题型:填空题
(10分)(1)常温下,某水溶液M中存在的离子有:Na+、A2-、HA-、H+、OH-,存在的分子有H2O、H2A。根据题意回答下列问题:
①写出酸H2A的电离方程式__________________________。
②若溶液M由2 mol·L-1NaHA溶液与2mol·L-1NaOH溶液等体积混合而得,则溶液M的pH ____7 (填“>”、“<”或“=”);溶液M中各微粒的浓度关系正确的是 。
A.c(Na+)>c(A2-)>c(OH-) >c(H+)
B. c(HA-) +c(H2A) +c(H+)=c(OH-)
C.c(A2-)+c(HA-) +c(H2A)=1 mol·L-1
D. c(A2-)+c(HA-)+c(OH-)=c(Na+)+c(H+)
(2)室温时,氢氧化钙的溶度积KSP =4.7×10-6, 室温时将9 mL0.02 mol·L—1的氯化钙溶液与1 mL pH=13的氢氧化钠溶液混合后(溶液体积可直接加和),溶液中___ 沉淀析出(填“有”或“无”)。
(3) 某校课外活动小组为测定已部分脱水的生石膏的组成(xCaSO4·yH2O),做如下实验:将固体加热,经测量剩余固体质量随时间变化如图所示。
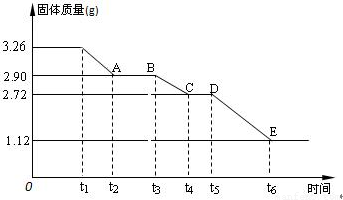
则x:y= 。t2~t3时间段固体的化学式为 。t5~t6时间段固体质量减轻的原因是产生了两种气体,其中一种能使品红溶液褪色。则该时间所发生反应的化学方程式为 。
查看答案和解析>>
科目:高中化学 来源:2010-2011学年福建省高三12月月考化学试卷 题型:实验题
(1)室温时氢氧化钙的溶度积KSP =4.7×10-6, 室温时将9 mL0.02 mol·L—1的氯化钙溶液与1 mL
pH=13的氢氧化钠溶液混合后(溶液体积可直接加和),溶液中 沉淀析出(填有或无).
(2)2.24升(标准状态)氨气通入250mL 浓度为0.1 mol·L—1的硫酸溶液中,充分反应后溶液中各离子浓度大小为 (按由大到小的顺序写出各离子符号)
(3) 人体血液含Ca2+。现抽取某人血样10 mL,稀释后用草酸铵[(NH4)2C2O4]溶液处理,使Ca2+完全转变为草酸钙(CaC2O4)沉淀;过滤,洗涤,将得到的沉淀用稀硫酸溶解得到草酸(H2C2O4)溶液,用5.0×10-3 mol·L-1 KMnO4溶液滴定得到的草酸至终点,共耗去2.0 mL KMnO4溶液。由上述实验数据可求得此人血液中Ca2+的物质的量浓度为 .(提示:2 KMnO4 + 5H2C2O4 + 3H2SO4 = 2MnSO4 + K2SO4 + 10CO2↑+8H2O)
(4)用下图完成相应实验.

①断开K1,闭合K2接通直流电源,写出阳极 的电极反应 .
电解的总反应方程式
②电解一段时间后,当两石墨棒均有气体包围时,切断K2闭合K1,发现电路中有电流通过. 写出a极的电极反应式
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com