
【题目】对于可逆反应mA(s)+nB(g)eC(g)+fD(g),反应过程中,当其它条件不变时C 的百分含量与温度 (T)和压强(P)关系如图所示,下面叙述正确的是( )
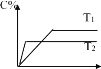
A.使用催化剂,C 的百分含量增大
B.升温,化学平衡向正反应方向移动
C.化学方程式的化学计量数关系 n<e+f
D.其他条件不变,增入 A 物质,提高 B 的转化率
【答案】C
【解析】
A. 使用催化剂,降低反应活化能,加快反应速率,平衡不移动,C 的百分含量不变,A错误;
B. 升高温度,反应速率加快,由C 的百分含量与温度 (T)的图可知,T2>T1,且T2时的C 的百分含量小于T1时的C 的百分含量,所以升高温度,化学平衡向逆反应方向移动,B错误;
C. 压强增大,反应速率加快,由C 的百分含量与温度 (P)的图可知,P2>P1,且P2时的C 的百分含量小于P1时的C 的百分含量,所以压强增大,化学平衡向逆反应方向移动,化学方程式的化学计量数关系 n<e+f,C正确;
D. 该反应中,A为固态,增入A物质,平衡不移动,B的转化率不变,D错误;故答案为:C。


科目:高中化学 来源: 题型:
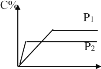
【题目】三元催化转化器能同时净化汽车尾气中的碳氢化合物(HC)、一氧化碳(CO)及氮氧化合物(NOx)三种污染物。催化剂选择铂铑合金,合金负载量不同时或不同的工艺制备的合金对汽车尾气处理的影响如图所示。下列说法正确的是
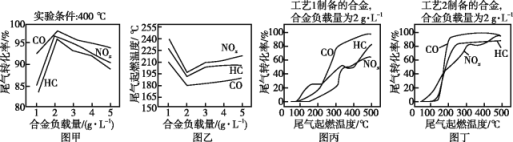
A.图甲表明,其他条件相同时,三种尾气的转化率随合金负载量的增大而增大
B.图乙表明,尾气的起燃温度随合金负载量的增大而降低
C.图甲和图乙表明,合金负载量越大催化剂活性越高
D.图丙和图丁表明,工艺2制得的合金的催化性能优于工艺1制得的合金
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在恒容密闭容器中,进行如下反应:NO(g)+CO(g)![]()
![]() N2(g)+CO2(g);△H=﹣373.2kJ/mol达到平衡后,为提高NO的转化率,采取的正确措施是( )
N2(g)+CO2(g);△H=﹣373.2kJ/mol达到平衡后,为提高NO的转化率,采取的正确措施是( )
A. 加催化剂B. 充入CO增大压强C. 充入N2D. 升高温度
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列反应中,浓硫酸既表现出强氧化性又表现出酸性的是( )
A. 2NaCl+H2SO4(浓)![]() Na2SO4+2HCl↑
Na2SO4+2HCl↑
B. Na2SO3+H2SO4(浓)![]() Na2SO4+SO2↑+H2O
Na2SO4+SO2↑+H2O
C. C+2H2SO4(浓)![]() CO2↑+2SO2↑+2H2O
CO2↑+2SO2↑+2H2O
D. 2FeO+4H2SO4(浓)![]() Fe2(SO4)3+SO2↑+4H2O
Fe2(SO4)3+SO2↑+4H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在恒容密闭容器中通入一定量的X气体与Y气体并发生反应:2X(g)+Y(g)2Z(g),测得在温度T1、T2下X的物质的量浓度c(x)随时间t变化的曲线如图所示,下列叙述正确的是
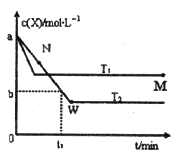
A.该反应进行到M点放出的热量大于进行到W点放出的热量
B.T2下,在0t1时间内,υ(Y)=![]()
C.M点的平衡常数比W点的平衡常数小
D.M点时再加入一定量的X,平衡后X的转化率增大
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】元素周期表中大多数元素是金属元素,金属及其化合物在生活生产中有着重要应用,根据试题信息,完成下列计算:
(1)某常见二价金属12.6g与足量稀硫酸反应,生成氢气5.04L(S.T.P),该元素原子的摩尔质量为__g/mol.
(2)39.32g某金属混合物,由12.32g镁和0.25mol另一种比镁不活泼的金属元素A组成,该混合物与一定量盐酸反应,产生氢气4.928L(S.T.P),则参加反应的HCl为__mol,金属A的相对原子质量为__.
(3)由NaCl、NaHCO3、Na2CO310H2O组成的混合物157.8g,充分加热后,产生的气体(气体温度150℃)依次通过无水CaCl2和碱石灰,两种吸收剂分别增重59.4g和13.2g,则混合物中NaHCO3的质量分数为___,若等质量的该混合物与足量盐酸反应,产生二氧化碳(S.T.P)__L.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】哈伯因发明了由氮气和氢气合成氨气的方法而获得1918年诺贝尔化学奖。现向一密闭容器中充入1mol N2和3mol H2,在一定条件下使该反应发生:N2+3H2![]() 2NH3。下列有关说法正确的是( )
2NH3。下列有关说法正确的是( )
A. 达到化学平衡时,正反应和逆反应的速率都为零
B. 当符合:3正N2=正H2时,反应达到平衡状态
C. 达到化学平衡时,单位时间消耗a molN2,同时生成3a molH2
D. 当N2、H2、NH3的分子数比为1∶3∶2,反应达到平衡状态
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用酸式滴定管准确移取 25.00mL 某未知浓度的盐酸于一洁净的锥形瓶中,然后用0.2000molL﹣1 的氢氧化钠溶液滴定(指示剂为酚酞),滴定结果如下:
NaOH 起始读数 | NaOH 终点读数 | |
第一次 | 0.10mL | 18.60mL |
第二次 | 0.30mL | 19.30mL |
第三次 | 0.50mL | 16.30mL |
(1)根据以上数据可以计算出盐酸的物质的量浓度为________molL﹣1。
(2)酸式滴定管使用的第一步操作是________
(3)以下操作造成测定结果偏高的原因可能是________。
A.振荡锥形瓶时有液滴溅出
B.滴定终点读数时,俯视滴定管的刻度,其它操作均正确
C.盛装未知液的锥形瓶用蒸馏水洗过,未用待测液润洗
D.滴定到终点读数时发现滴定管尖嘴处悬挂一滴溶液
E.未用标准液润洗碱式滴定管
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】舍勒发现氯气是在1774年,当时他正在研究软锰矿(二氧化锰),当他使软锰矿与浓盐酸混合并加热时,产生了一种黄绿色的气体,发生反应的方程式为MnO2+4HCl(浓)![]() MnCl2+Cl2↑+2H2O,这种气体的强烈的刺激性气味使舍勒感到极为难受,但是当他确信自己制得了一种新气体后,他又感到一种由衷的快乐。舍勒制备出氯气以后,把它溶解在水里,发现这种水溶液对纸张、蔬菜和花都具有永久性的漂白作用;他还发现氯气能与金属、非金属、碱等发生化学反应。
MnCl2+Cl2↑+2H2O,这种气体的强烈的刺激性气味使舍勒感到极为难受,但是当他确信自己制得了一种新气体后,他又感到一种由衷的快乐。舍勒制备出氯气以后,把它溶解在水里,发现这种水溶液对纸张、蔬菜和花都具有永久性的漂白作用;他还发现氯气能与金属、非金属、碱等发生化学反应。
舍勒发现氯气是在1774年,当时他正在研究软锰矿(二氧化锰),当他使软锰矿与浓盐酸混合并加热时,产生了一种黄绿色的气体,发生反应的方程式为MnO2+4HCl(浓)![]() MnCl2+Cl2↑+2H2O,这种气体的强烈的刺激性气味使舍勒感到极为难受,但是当他确信自己制得了一种新气体后,他又感到一种由衷的快乐。舍勒制备出氯气以后,把它溶解在水里,发现这种水溶液对纸张、蔬菜和花都具有永久性的漂白作用;他还发现氯气能与金属、非金属、碱等发生化学反应。
MnCl2+Cl2↑+2H2O,这种气体的强烈的刺激性气味使舍勒感到极为难受,但是当他确信自己制得了一种新气体后,他又感到一种由衷的快乐。舍勒制备出氯气以后,把它溶解在水里,发现这种水溶液对纸张、蔬菜和花都具有永久性的漂白作用;他还发现氯气能与金属、非金属、碱等发生化学反应。
(1)氯气和氢气的反应的属于____________
A.分解反应 B.化合反应 C.置换反应 D.复分解反应
(2)对于反应MnO2+4HCl(浓)![]() MnCl2+Cl2↑+2H2O,下列说法正确的是_____________
MnCl2+Cl2↑+2H2O,下列说法正确的是_____________
A.MnO2是还原剂 B.MnCl2是氧化产物
C.Cl2是氧化产物 D.H2O是还原产物
(3)下列反应条件的改变对实验室制备氯气速率的影响正确的是_____________
A.增大盐酸的浓度能加快反应速率
B.若用稀盐酸与二氧化锰反应则反应速率较慢
C.升高温度能减慢反应速率
D.增加MnO2的质量可显著加快反应速率
(4)氢气在氯气中燃烧为放热反应,下列说法正确的是________________
A.断开Cl—Cl键放出能量 B.形成H—Cl键吸收能量
C.燃烧都是放热反应 D.反应物的总能量小于生成物的总能量
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com