

 ,故答案为:
,故答案为: ;
; =
= ;
; ;温度升高,反应速率加快,达到平衡所需的进间缩短;
;温度升高,反应速率加快,达到平衡所需的进间缩短; 2Fe3++H2↑,
2Fe3++H2↑, 2Fe3++H2↑.
2Fe3++H2↑.

 全优点练单元计划系列答案
全优点练单元计划系列答案科目:高中化学 来源: 题型:单选题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 甲 | 乙 | 丙 | 丁 | |
| 甲 | - | ↓ | ↓ | - |
| 乙 | ↓ | - | ↓ | ↑ |
| 丙 | ↓ | ↓ | - | ↓ |
| 丁 | - | ↑ | ↓ | - |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
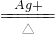 16H++10RO42-+2MnO4-
16H++10RO42-+2MnO4-查看答案和解析>>
科目:高中化学 来源: 题型:解答题


查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com