
| 实验编号 | HA物质的量浓度 (mol•L-1) | NaOH物质的量浓度 (mol•L-1) | 混合溶液的pH |
| 甲 | 0.2 | 0.2 | pH=a |
| 乙 | C1 | 0.2 | pH=7 |
| 丙 | 0.1 | 0.1 | pH>7 |
| 丁 | 0.1 | 0.1 | pH=10 |
分析 (1)等浓度、等体积的HA和NaOH混合,二者恰好反应生成盐和水,如果NaA是强碱弱酸盐,其溶液呈碱性;如果NaA是强酸强碱盐,其水溶液呈中性;
(2)酸碱体积相等,如果HA是弱酸,则NaA是强碱弱酸盐,其水溶液呈碱性,要使混合溶液呈中性HA应该稍微过量;如果NaA是强酸强碱盐,其水溶液呈中性,则二者物质的量相等;根据电荷守恒判断c(A-)与c(Na+)相对大小;
(3)等体积等浓度的HA和NaOH混合后,二者恰好反应生成NaA和水,其水溶液呈碱性,说明NaA是强碱弱酸盐,酸根离子水解导致溶液呈碱性,但其水解程度较小;
(4)酸或碱抑制水电离,含有弱离子的盐促进水电离,丁组中酸碱恰好完全反应生成盐NaA,丁组实验所得混合溶液中由水电离出的c(OH-)=$\frac{{K}_{w}}{1{0}^{-pH}}$.
解答 解:(1)等浓度、等体积的HA和NaOH混合,二者恰好反应生成盐和水,如果NaA是强碱弱酸盐,其溶液呈碱性,pH>7,则HA是弱酸;如果NaA是强酸强碱盐,其水溶液呈中性,pH=7,则HA是强酸,故答案为:若pH=7,HA是强酸,若pH>7,则HA是弱酸;
(2)酸碱体积相等,如果HA是弱酸,则NaA是强碱弱酸盐,其水溶液呈碱性,要使混合溶液呈中性HA应该稍微过量;如果NaA是强酸强碱盐,其水溶液呈中性,则二者物质的量相等,且二者体积相等,则其浓度相等,所以c1不一定等于0.2mol•L-1;溶液呈中性,则c(OH-)=c(H+),结合电荷守恒得c(A-)=c(Na+),故选C,
故答案为:否;C;
(3)等体积等浓度的HA和NaOH混合后,二者恰好反应生成NaA和水,其水溶液呈碱性,说明NaA是强碱弱酸盐,所以HA是弱酸,A-水解导致溶液呈碱性,c(OH-)>c(H+),一般来说,盐类的水解程度较低,则有c(A-)>c(OH-),所以有:c(Na+)>c(A-)>c(OH-)>c(H+),
故答案为:弱;c(Na+)>c(A-)>c(OH-)>c(H+);
(4)酸或碱抑制水电离,含有弱离子的盐促进水电离,丁组中酸碱恰好完全反应生成盐NaA,丁组实验所得混合溶液中由水电离出的c(OH-)=$\frac{{K}_{w}}{1{0}^{-pH}}$=$\frac{1{0}^{-14}}{1{0}^{-10}}$mol/L=10-4 mol/L,
故答案为:10-4.
点评 本题考查酸碱混合的判断,题目难度中等,本题注意分析表中数据,从弱电解质的电离和盐类水解的角度解答,学习中注重相关规律和方法的积累,易错点是(4)题水电离出c(OH-)、c(H+)的方法.


科目:高中化学 来源: 题型:填空题
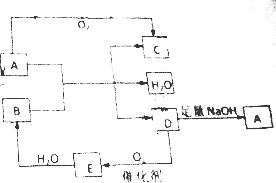 A、B、C、D、E五种物质都含有同一种元素,其中D在常温下为无色有刺激性气味的有毒气体,在一定条件下有如图所示的转化关系.
A、B、C、D、E五种物质都含有同一种元素,其中D在常温下为无色有刺激性气味的有毒气体,在一定条件下有如图所示的转化关系. ;
;查看答案和解析>>
科目:高中化学 来源: 题型:解答题
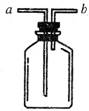 现有如图所示装置,为实现下列实验目的
现有如图所示装置,为实现下列实验目的查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | NH4Cl中有离子键,是离子化合物 | |
| B. | 46g C2H5OH燃烧放出的热量为乙醇的燃烧热 | |
| C. |  和 和 互为同系物 互为同系物 | |
| D. | 绿色化学的核心是应用化学原理对环境污染进行治理 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 0.3 mol/L Na2SO4溶液中含有Na+和SO42-总物质的量为0.9mol | |
| B. | 当1L水吸收22.4LNH3时所得氨水的浓度不是1 mol/L,只有当22.4L NH3溶于水制得1L氨水时,其浓度才是1 mol/L | |
| C. | 10℃时0.5 mol/L的稀盐酸100mL,蒸发掉5g水,冷却到10℃时,其体积小于100mL,它的物质的量浓度大于0.5 mol/L | |
| D. | 10℃时0.5 mol/L的KCl饱和溶液100mL,蒸发掉5g水,冷却到10℃时,其体积小于100 mL,它的物质的量浓度仍为0.5 mol/L |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 用pH试纸测定Na2CO3溶液的pH | |
| B. | 从食盐水中提取NaCl | |
| C. | 用新制的FeSO4溶液和NaOH溶液制备Fe(OH)2 | |
| D. | 配制100ml 0.1000mol/L的NaCl溶液 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 1mol A+0.5mol B+1.5mol C+0.1mol D | |
| B. | 3mol C+0.5mol D | |
| C. | 2mol A+1mol B+1molD | |
| D. | 0.5mol A+0.25mol B+2.25mol C |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com