
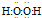 .
.分析 A、B、C、D、E五种短周期主族元素中,它们的原子序数依次增大,A、D都能与C按原子个数比为1:1或2:1形成的化合物,则A为H元素、D为Na元素、C为O元素;A、B组成的气态化合物的水溶液呈碱性,则B为N元素,E与C的最外层电子数相同,即E、C同主族,E为S,以此来解答.
解答 解:A、B、C、D、E五种短周期主族元素中,它们的原子序数依次增大,A、D都能与C按原子个数比为1:1或2:1形成的化合物,则A为H元素、D为Na元素、C为O元素;A、B组成的气态化合物的水溶液呈碱性,则B为N元素,E与C的最外层电子数相同,即E、C同主族,E为S,
(1)A与C按原子个数比为1:1形成化合物为H2O2,电子式是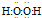 ,故答案为:
,故答案为: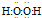 ;
;
(2)非金属性O>S,元素的非金属性越强,对应的氢化物越稳定,为H2O>H2S,故答案为:H2O;H2S;
(3)该电池的正极上氮气得到电子生成铵根离子,则正极反应式N2+6e-+8H+=2NH4+,负极氢气被氧化生成H+,电池反应式为N2+3H2+2HCl=2NH4Cl,放电时,阳离子H+、NH4+向正极移动,
故答案为:N2+3H2+2HCl=2NH4Cl; H+、NH4+;
(4)生成了浅绿色溶液M为氯化亚铁,M的酸性溶液和A与C形成的一种化合物(过氧化氢)发生氧化还原反应,反应的离子方程式为2Fe2++H2O2+2H+=2Fe3++2H2O,
故答案为:2Fe2++H2O2+2H+=2Fe3++2H2O.
点评 本题考查位置、结构、性质及应用,为高频考点,把握元素的位置、性质及元素化合物知识推断元素为解答的关键,侧重分析与推断能力的综合考查,题目难度中等.


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:选择题
| A. | △H>0表示放热反应,△H<0表示吸热反应 | |
| B. | 反应产物的总焓大于反应物的总焓时,△H>0 | |
| C. | △H的大小与热化学方程式中的各物质的化学计量数无关 | |
| D. | 在化学反应中,发生物质变化的同时不一定发生能量变化 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
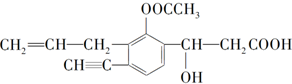 某有机化合物结构简式为
某有机化合物结构简式为查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 中和pH和体积都相同的盐酸和醋酸,消耗NaOH的物质的量之比为1:1 | |
| B. | pH=3的盐酸和pH=3的FeCl3溶液中,水电离的c(H+)相等 | |
| C. | 0.1 mol•L-1 NaHCO3溶液中:c(Na+)>c(HCO3-)>c(H2CO3)>c(CO32-) | |
| D. | 浓度均为0.1 mol/L的三种溶液:①Na2CO3溶液;②NaOH溶液;③CH3COONa溶液,溶液的pH:②>③>① |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 元素周期表中,除第一和第七周期外,第n周期所含非金属元素的种数均为(8-n) | |
| B. | SiCl4、PCl3分子中各原子最外层均达到8电子稳定结构 | |
| C. | 气态氢化物的水溶液都是酸 | |
| D. | ⅠA族和ⅥA族元素形成的原子个数比1:1、电子总数38的化合物,是有共价键的离子化合物 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
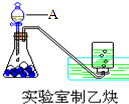 (1)实验室制取乙炔的实验装置图(如图)中,A仪器的名称为分液漏斗;所盛的试剂为饱和食盐水.发生反应的化学方程式为:CaC2+2H2O→Ca(OH)2+CH≡CH↑.
(1)实验室制取乙炔的实验装置图(如图)中,A仪器的名称为分液漏斗;所盛的试剂为饱和食盐水.发生反应的化学方程式为:CaC2+2H2O→Ca(OH)2+CH≡CH↑.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 3n-12 | B. | 3n-6 | C. | 3n-4 | D. | 2n-4 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①③④ | B. | ①②③ | C. | ②③④ | D. | ①②③④ |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com