
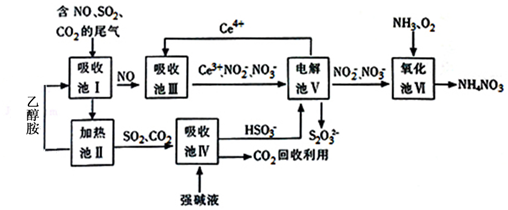
分析 由流程可知,吸收池I中发生SO2+OH-=HSO3-、CO2+OH-=HCO3-,NO不反应,吸收池Ⅲ中,酸性条件下NO转化为NO2-,发生NO+H2O+Ce4+=Ce3++NO2-+2H+,吸收池Ⅳ中NaHSO3溶液中HSO3-的电离大于水解,HSO3-?SO32-+H+,溶液显示酸性,加入CaCl2溶液后,Ca2++SO32-=CaSO3↓使电离平衡右移,电解池Ⅴ可使Ce4+再生,Ce失去电子在阳极得到,阴极上发生2HSO3-+4H++4e-=S2O32-+3H2O,氧化池Ⅵ中得到粗产品NH4NO3,NO2-完全转化为NH4NO3,电解池V中S得到电子,氧化池Ⅵ中氧得到电子,结合电子守恒计算.
解答 解:由流程可知,吸收池I中发生SO2+OH-=HSO3-、CO2+OH-=HCO3-,NO不反应,吸收池Ⅲ中,酸性条件下NO转化为NO2-,发生NO+H2O+Ce4+=Ce3++NO2-+2H+,吸收池Ⅳ中NaHSO3溶液中HSO3-的电离大于水解,HSO3-?SO32-+H+,溶液显示酸性,加入CaCl2溶液后,Ca2++SO32-=CaSO3↓使电离平衡右移,电解池Ⅴ可使Ce4+再生,Ce失去电子在阳极得到,阴极上发生2HSO3-+4H++4e-=S2O32-+3H2O,氧化池Ⅵ中得到粗产品NH4NO3,
(1)由上述分析可知,可循环利用,且流程中CO2回收应用,故答案为:Ce4+、CO2;
(2)乙醇胺(HOCH2CH2NH2),其水溶液具有弱碱性,显碱性的原因:HOCH2CH2NH2+H2O?HOCH2CH2NH3++OH-,乙醇胺吸收CO2的化学方程式为HOCH2CH2NH2+H2O+CO2=HOCH2CH2NH4HCO3,
故答案为:HOCH2CH2NH2+H2O+CO2=HOCH2CH2NH4HCO3;
(3)吸收池Ⅲ中,酸性条件下NO转化为NO2-的离子方程式为NO+H2O+Ce4+=Ce3++NO2-+2H+,故答案为:NO+H2O+Ce4+=Ce3++NO2-+2H+;
(4)NaHSO3溶液中HSO3-的电离大于水解,HSO3-?SO32-+H+,溶液显示酸性,加入CaCl2溶液后,Ca2++SO32-=CaSO3↓使电离平衡右移,
故答案为:HSO3-在溶液中存在电离平衡:HSO3-?SO32-+H+,加CaCl2溶液后,Ca2++SO32-=CaSO3↓使电离平衡右移,c(H+)增大;
(5)在电解池中,阳极上是Ce3+失电子成为Ce4+的过程,所以生成Ce4+从电解槽的阳极上极a极流出,电解池的阴极发生得电子的还原反应,电极反应式为2HSO3-+4H++4e-=S2O32-+3H2O,
故答案为:a;2HSO3-+4H++4e-=S2O32-+3H2O;
(6)从氧化池Ⅵ中得到粗产品NH4NO3的实验操作是蒸发浓缩、冷却结晶、过滤、洗涤等.上述流程中每一步均恰好完全反应,若制得NH4NO3质量为xkg,电解池V制得cmol/L的S2O32-溶液ym3,由电子守恒可知,则氧化池Ⅵ中消耗的O2在标准状况下的体积为$\frac{y×1{0}^{3}×cmol×2×(4-2)}{2×(2-0)}$mol×22.4L/mol×10-3m3/L=22.4ycm3,
故答案为:蒸发浓缩;冷却结晶;22.4yc.
点评 本题考查混合物分离提纯,为高频考点,把握流程中的反应及混合物分离方法选择为解答的关键,侧重分析与应用能力的考查,综合性较强,题目难度较大.


 字词句段篇系列答案
字词句段篇系列答案科目:高中化学 来源: 题型:选择题
| A. | 11.2 g Fe投入到400 mL 1 mol/L的硝酸中充分反应,转移电子总数为0.2 NA | |
| B. | 标准状况下,11.2 L C2H6含3 NA个C-H极性共价键 | |
| C. | 标准状况下,5.6 L NO和5.6 L O2混合后的分子总数为0.5 NA | |
| D. | 标准状况下,铝跟氢氧化钠溶液反应生成1 mol氢气时,转移的电子数为NA |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
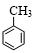 +3HNO3$→_{△}^{浓硫酸}$
+3HNO3$→_{△}^{浓硫酸}$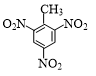 +3H2O.
+3H2O.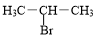 +NaOH$→_{△}^{H_{2}O}$
+NaOH$→_{△}^{H_{2}O}$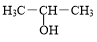 +NaBr.
+NaBr.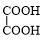 +
+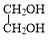 $→_{△}^{催化剂}$
$→_{△}^{催化剂}$ +2H2O.
+2H2O.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 正极有 O2 逸出 | |
| B. | 铜片上有 H2 逸出 | |
| C. | 电子通过导线由铜片流向锌片 | |
| D. | 正极附近的 SO42- 离子浓度逐渐增大 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | SO2具有还原性,可用于蔗糖脱色 | |
| B. | 双氧水具有强氧化性,可用于杀菌消毒 | |
| C. | 铁粉表面积大,可用作食品干燥剂 | |
| D. | SiO2具有导电性,可用于制造光导纤维 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | $\frac{{K}_{w}}{c(O{H}^{-})}$=0.1mol•L-1的溶液:Na+、K+、SiO32-、NO3- | |
| B. | 遇苯酚显紫色的溶液:I-、K+、SCN-、Mg2+ | |
| C. | 与铝反应产生大量氢气的溶液:NH4+、Na+、CO32-、NO3- | |
| D. | 加入NaOH后加热既有气体放出又有沉淀生成的溶液:Ca2+、HCO3-、NH4+、CH3COO- |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com