
| A. | 同一元素不可能既表现金属性,又表现非金属性 | |
| B. | 第三周期元素的最高正化合价等于它所处的主族序数 | |
| C. | 短周期元素形成离子后,最外层电子都达到2电子或8电子稳定结构 | |
| D. | 同一主族的元素的原子,最外层电子数相同,化学性质完全相同 |
分析 A.处于金属与非金属交界处的元素通常表现一定的金属性与非金属性;
B.第三周期元素的最高正化合价等于等于最外层电子数,与主族序数相等;
C.氢原子变成氢离子后最外层不含电子;
D.同一主族的元素的原子,化学性质具有相似性和递变性.
解答 解:A.元素周期表中处于金属与非金属交界处的元素通常表现一定的金属性与非金属性,故A错误;
B.第三周期元素的最高正化合价等于等于最外层电子数,与主族序数相等,故B正确;
C.氢原子变成氢离子后,H+离子原子核外没有电子,故C错误;
D.同一主族的元素的原子,化学性质具有相似性和递变性,不完全相同,故D错误;
故选B.
点评 本题考查了原子结构与元素周期律的应用,题目难度不大,明确常见元素原子结构与元素周期律的关系为解答关键,C为易错点,注意氢离子核外不含电子,试题培养了学生的灵活应用能力.


 第1卷单元月考期中期末系列答案
第1卷单元月考期中期末系列答案科目:高中化学 来源: 题型:解答题
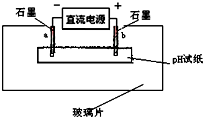
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
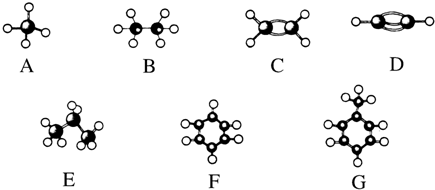
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 1mol•L-1 的AlCl3溶液中,含Al3+数小于NA | |
| B. | 标准状况下,将2.24L 氯化氢溶于足量水中,溶液中含有的HCl分子数为NA | |
| C. | 1mol NaBH4中含的离子的数目为6NA | |
| D. | 30g甲醛(HCHO)和醋酸的混合物中含碳原子数目为NA |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
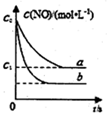 一定条件下,恒容密闭容器中发生反应2NO(g)?N2(g)+O2(g),图中,曲线a表示该反应在T温度下NO的浓度随时间的变化;曲线b表示该反应在某一起始条件改变时N2的浓度随时间的变化.下列叙述正确的是( )
一定条件下,恒容密闭容器中发生反应2NO(g)?N2(g)+O2(g),图中,曲线a表示该反应在T温度下NO的浓度随时间的变化;曲线b表示该反应在某一起始条件改变时N2的浓度随时间的变化.下列叙述正确的是( )| A. | T温度下,该反应的平衡常数K=$\frac{4({c}_{0}-{c}_{1})^{2}}{{{c}_{1}}^{2}}$ | |
| B. | T温度下,随着反应的进行,混合气体的密度减小 | |
| C. | 曲线b对应的条件改变可能是加入了催化剂 | |
| D. | 若曲线b对应的条件改变是温度,可判断该反应的△H>0 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com