
����Ŀ��ͨ�����ǰѲ�1mol ij��ѧ�������յ��������ɸû�ѧ���ļ��ܡ����ܵĴ�С�����ڹ��㻯ѧ��Ӧ�ķ�Ӧ��(��H)��
��ѧ�� | Cl��Cl | H��H | H��Cl | N��N |
����/kJ��mol | 243 | 436 | 431 | 946 |
(1)��Ҫ��������
a.2HCl(g) �� H2(g)��Cl2(g)����H=______________________
b.N2 (g)+3H2(g)= 2NH3(g) ��H=-92kJ/mol����N��H���ļ�����__________kJ��mol
(2)1 mol NO2��1mol CO��Ӧ����CO2��NO�����������仯ʾ��ͼ����д��NO2��CO��Ӧ���Ȼ�ѧ����ʽ__________________________________

(3) ��֪�ڳ��³�ѹ�£�
�� 2CH3OH(l) �� 3O2(g) �� 2CO2(g) �� 4H2O(g) ��H1
�� 2CO (g)+ O2(g) �� 2CO2(g) ��H2
�� H2O(g) �� H2O(l) ��H3
��CH3OH(l)��O2(g)=CO(g)+ 2H2O(l)��H =__________(�ú���H1����H2����H3��ʽ�ӱ�ʾ)
(4)��֪��2Al (s)+ 3/2O2(g)==Al2O3(s) ��H=-1644.3 kJ mol-1
2Fe (s) +3/2O2(g)==Fe2O3(s) ��H=-815.88kJ mol-1
��д����������������ĩ�������ȷ�Ӧ���Ȼ�ѧ����ʽ_______________________��
���𰸡���H=+183kJ/mol 391 NO2(g) + CO(g) = CO2(g) + NO(g) ��H =-234kJ��mol-1 ![]() ��H1-
��H1-![]() ��H2+2��H3 2Al (s) + Fe2O3(s) === Al2O3(s) +2Fe (s) ��H= -828.42 kJ mol-1
��H2+2��H3 2Al (s) + Fe2O3(s) === Al2O3(s) +2Fe (s) ��H= -828.42 kJ mol-1
��������
(1)a�����ݾɼ�������Ҫ�����������¼�������Ҫ�ų�����������÷�Ӧ�ķ�Ӧ�ȣ�
b����N-H���ļ���Ϊx�����ݻ�ѧ���뻯ѧ��Ӧ�������仯�Ĺ�ϵ�����������ļ��ܣ�
(2)���������仯ͼ�������������������Ӧ����������Ǹ÷�Ӧ�ȣ�
(3)����֪��Ӧ����ʽͨ���仯�������ʽ�����ҷ�Ӧ�Ƚ�����Ӧ�ı仯���������������������Ӧ�ķ�Ӧ�ȣ�
(4)����֪��Ӧ����ʽͨ���仯�������ʽ�����ҷ�Ӧ�Ƚ�����Ӧ�ı仯���������������������Ӧ�ķ�Ӧ�ȡ�
(1)a����Ӧ2HCl(g)=H2(g)+Cl2(g)�У�����2molH-Cl����Ҫ���յ�����Ϊ��431kJ/mol��2=862kJ/mol������1molH-H����1nolCl-Cl�ų�������Ϊ��243kJ/mol+436kJ/mol=679kJ/mol����Ȼ�÷�ӦΪ���ȷ�Ӧ�����յ�����Ϊ��862kJ/mol-679kJ/mol=183kJ/mol������H=+183kJ/mol��
b��N2(g)+3H2(g)=2NH3(g)��H=-92kJ/mol���÷�ӦΪ���ȷ�Ӧ��˵���ɼ��������յ����������¼����ɷų�������������N-H���ļ���Ϊx����ѧ�����Ѻ��γɹ����������仯Ϊ��x��2��3-(946kJ/mol+436kJ/mol��3)=92kJ/mol�����x=391kJ/mol��
(2)��Ӧ������ʵ�����Ϊ1mol�������䷴Ӧ��ļ�����Ϊ1���ٸ���ԭ���غ���ƽ����ʽ������ͼ��֪����H=-(E2-E1)=-(368-134)kJ/mol=-234 kJmol-1�����Ȼ�ѧ����ʽΪNO2(g)+CO(g)=CO2(g)+NO(g)��H=-234 kJmol-1��
(3)��2CH3OH(l)+3O2(g)=2CO2(g)+4H2O(g)��H1����2CO(g)+O2(g)=2CO2(g)��H2����H2O(g)=H2O(l)��H3����CH3OH(l)+O2(g)=CO(g)+2H2O��![]() ��-
��-![]() ��+2�۵õ���������H=
��+2�۵õ���������H=![]() ��H1-
��H1-![]() ��H2+2��H3��
��H2+2��H3��
(4)���ȷ�Ӧ�ķ�Ӧ������������������ĩ����������������������
2Al(s)+![]() O2(g)�TAl2O3(s)��H=-1644.3kJmol-1 �٣�2Fe(s)+
O2(g)�TAl2O3(s)��H=-1644.3kJmol-1 �٣�2Fe(s)+![]() O2(g)�TFe2O3(s)��H=-815.88kJmol-1 �ڣ�����ʽ��-�ڵ�2Al(s)+Fe2O3(s)
O2(g)�TFe2O3(s)��H=-815.88kJmol-1 �ڣ�����ʽ��-�ڵ�2Al(s)+Fe2O3(s)![]() Al2O3(s)+2Fe(s)��������H=��H(��)-��H(��)=-1644.3kJmol-1-(-815.88kJmol-1)=-828.42kJmol-1�����Ȼ�ѧ����ʽΪΪ��2Al(s)+Fe2O3(s)�TAl2O3(s)+2Fe(s)��H=-828.42kJmol-1��
Al2O3(s)+2Fe(s)��������H=��H(��)-��H(��)=-1644.3kJmol-1-(-815.88kJmol-1)=-828.42kJmol-1�����Ȼ�ѧ����ʽΪΪ��2Al(s)+Fe2O3(s)�TAl2O3(s)+2Fe(s)��H=-828.42kJmol-1��



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����Ͳ���ң���M��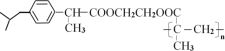 ���dz����ڽ�����ʹҩ�M��һ�ֺϳ�·����ͼ��
���dz����ڽ�����ʹҩ�M��һ�ֺϳ�·����ͼ��
��֪��RCOOR��+R��OH![]() RCOOR��+R��OH
RCOOR��+R��OH
�밴Ҫ��ش��������⣺
��Aϵͳ���������ƣ�__����Ӧ������Ϊ__��C���������ŵĽṹ��ʽ��__���Լ��ķ���ʽ��__��J��M��Ӧ���ͣ�__��
��A��ͬ���칹���ж��֣������ܷ���������Ӧ�Һ����ǻ�����_�֣�д�����к˴Ź���������3��壬�����֮��Ϊ6��1��1�Ľṹ��ʽ__��
��д��D+I��J��Ӧ�Ļ�ѧ����ʽ��__��
���Ա���![]() ����ͪ�������
����ͪ�������![]() ��Ϊ��ʼԭ���Ʊ��л���N��
��Ϊ��ʼԭ���Ʊ��л���N��![]() ����д��N�ĺϳ�·��___�������Լ���ѡ���ϳ�·��ʾ������ɣ��л����д�ṹ��ʽ����
����д��N�ĺϳ�·��___�������Լ���ѡ���ϳ�·��ʾ������ɣ��л����д�ṹ��ʽ����

�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�������й�ʵ��˵��������ȷ����( )
A.���Ӳ���մ��Ƥ���ϣ�Ӧ�����þƾ�ϴ�ӣ����ô���ˮ��ϴ
B.�ų���ʽ�ζ��ܼ��������ʱ��Ӧ��ѹ������ʹҺ��������������³������
C.�������Ƶ�![]() ����Һ���������д��ڵĸ���
����Һ���������д��ڵĸ���
D.������������ϡ����ɼ���![]() ��
��![]()
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������˵����ȷ���ǣ� ��
A.��д�Ȼ�ѧ����ʽʱ��ֻҪ�ڻ�ѧ����ʽ���Ҷ�д�������ķ��ź���ֵ����
B.�����ڼ��Ȼ��ȼ�����½��еķ�Ӧ�������ȷ�Ӧ
C.������Ӧ���ų������������Ļ�ѧ����ʽ�����Ȼ�ѧ����ʽ
D.������������ȼ�յ��Ȼ�ѧ����ʽ�ǣ�![]() ��
��![]()
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����ж���ˮ�����Ļ�ѧ��������ԭ��������������ǣ� ��
A. ����������ˮ�оͻᷢ����Ӧ�� Al3++3H2O![]() Al(OH)3(����)+3H+
Al(OH)3(����)+3H+
B. �������������к���������Ƴ����������Է�ˮ���������CO2�кͼ��Է�ˮ
C. ���ó�����Ӧ�dz�ȥˮ���ؽ������ӳ��õķ���
D. ���������ؽ������ӵķ�ˮһ�����漰������ԭ��Ӧ
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����ͼΪ���ȷ�Ӧ��ʵ��װ�ã���ش��������⣺

(1)��ʵ��װ���л�ȱ________���������ȷ�Ӧ�IJ���Ϊ_______��
(2)������������������þ���÷�Ӧ____(������������������)������������______��
(3)���ȷ�Ӧ����;����Щ__________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���ҹ���ѧ���з���һ�����������ɺ�������Na-CO2���ε�ء���NaClO4�����л��ܼ���Ϊ���Һ���ƺ���̼���ܵ������ֱ���Ϊ�缫���ϣ���ص��ܷ�ӦΪ��![]() ������˵��������ǣ� ��
������˵��������ǣ� ��
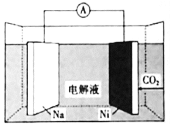
A.�ŵ�ʱ��NaΪ��صĸ���
B.���ʱ�ͷ�CO2���ŵ�ʱ����CO2
C.�ŵ�ʱ��������ӦΪ��![]()
D.���ʱ�������ͷ�6.72L CO2ʱ��ת�Ƶĵ�����Ϊ0.4NA
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ʵ������ȡ�������������������100 mL 1.7mol/L��NaOH��Һ��ȫ���ա������պ����Һ���з������飬��֪c(OH-)=0.1mol/L (�����Ƿ�Ӧǰ����Һ������仯) ��ClO����ClO3�������ʵ���Ũ��֮��Ϊ5��1����ش�
��1�������������ĵ�NaOH�����ʵ���Ϊ_______________mol��
��2�������������������ʵ���Ϊ_______________mol������ԭ�����������ʵ���Ϊ _______________mol��
��3�������ö������̺�Ũ���Ṳ�ȵķ������������Ʊ�β���е����������ĵĶ������̵�����Ϊ_______________g��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��A��B��C��D��E���ֶ���������Ԫ�أ�ԭ������������������C��D��Eͬ���ڣ�A��Cͬ���壬B��Eͬ���壬BԪ�ص�ԭ�������������Ǵ�������������������֪A�������ܶ���С�����塣
��ش��������⣺
��1��Ԫ��C�����ڱ��е�λ��______________________________��
��2��A��C��E��ԭ�Ӹ�����1��1��1�γɻ�����X�������ʽΪ_________________��
��3��B��E��Ӧ���⻯���ȶ��ԵĴ�С˳���ǣ��÷���ʽ��ʾ�� ________________��
��4����D�Ƿǽ���Ԫ�أ��䵥���ڵ��ӹ�ҵ������ҪӦ�ã���д��������������ǿ����Һ�����ӷ���ʽ��___________________________________________��
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com