
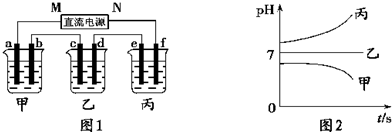
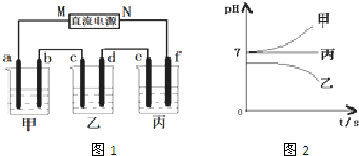
| A、甲、丙中是化学能转变为电能,乙中是电能转变为化学能 | B、C1、C2分别是阳极、阴极,锌片、铁片上都发生氧化反应 | C、C1和C3放出的气体相同,铜片和铁片放出的气体也相同 | D、甲、乙中溶液的pH值逐渐升高,丙中溶液的pH逐渐减小 |


科目:高中化学 来源: 题型:
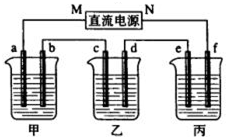 如图所示装置中,甲、乙、丙三个烧杯依次分别盛放109g5.51%的NaOH溶液、足量的CuSO4溶液和200g10.00%的K2SO4溶液.电极均为石墨电极.接通电源,经过一段时间后,测得丙中K2SO4浓度为10.47%,乙中c电极质量增加.据此回答问题:
如图所示装置中,甲、乙、丙三个烧杯依次分别盛放109g5.51%的NaOH溶液、足量的CuSO4溶液和200g10.00%的K2SO4溶液.电极均为石墨电极.接通电源,经过一段时间后,测得丙中K2SO4浓度为10.47%,乙中c电极质量增加.据此回答问题:查看答案和解析>>
科目:高中化学 来源: 题型:
| ||
| ||
查看答案和解析>>
科目:高中化学 来源: 题型:阅读理解
| ||
| ||
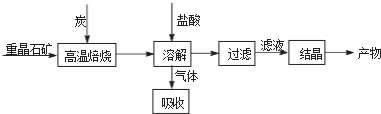
| 高温 |
| 高温 |
| 高温 |
查看答案和解析>>
科目:高中化学 来源:2010年福建省厦门市高一下学期质量检测化学试题 题型:实验题
为测定镁铝合金(不含其它元素)中铝的质量分数,甲、乙、丙三个学习小组设计了下列三种不同的实验方案进行探究。请回答下列问题: (一)甲组:实验方案:镁铝合金
(一)甲组:实验方案:镁铝合金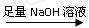 测定剩余固体质量
测定剩余固体质量
实验步骤:
①称量:托 盘天平称量一定质量镁铝合金粉末
盘天平称量一定质量镁铝合金粉末
②溶解:将①中药品加入烧杯中,加入过量的NaOH溶液,不断搅拌,充分反应。发生反应的离子方程式为
③过滤:
④洗涤:若未对过滤所得固体进行洗涤,测得铝的质量分数将 (填“偏高”、“偏低”或“不变”)
⑤干燥、称量剩余固体 (二)乙组:实验方案:镁铝合金
(二)乙组:实验方案:镁铝合金 测定生成气体的体积
测定生成气体的体积
实验装置如右下图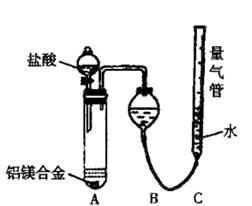
(1)某同学提出该实验装置不够完善,应在A、B之间添加一个装有碱石灰的干燥装置。你的意见是 (填“需要”或“不需要”)
(2)为使测定结果尽可能精确,实验中应注意的问题是(要求写出二点) 、
(三)丙组:实验方案:12 g镁铝合金
操作l包括过滤、洗涤、干燥和称量, 并最终得到固体物质1.45g。则该合金中铝的质量分数为 。
并最终得到固体物质1.45g。则该合金中铝的质量分数为 。
查看答案和解析>>
科目:高中化学 来源:2010年福建省厦门市高一下学期质量检测化学试题 题型:实验题
为测定镁铝合金(不含其它元素)中铝的质量分数,甲、乙、丙三个学习小组设计了下列三种不同的实验方案进行探究。请回答下列问题:
(一)甲组:实验方案:镁铝合金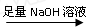 测定剩余固体质量
测定剩余固体质量
实验步骤:
①称量:托盘天平称量一定质量镁铝合金粉末
②溶解:将①中药品加入烧杯中,加入过量的NaOH溶液,不断搅拌,充分反应。发生反应的离子方程式为
③过滤:
④洗涤:若未对过滤所得固体进行洗涤,测得铝的质量分数将 (填“偏高”、“偏低”或“不变”)
⑤干燥、称量剩余固体
 (二)乙组:实验方案:镁铝合金
(二)乙组:实验方案:镁铝合金 测定生成气体的体积
测定生成气体的体积
实验装置如右下图
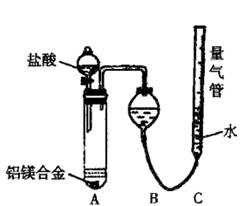
(1)某同学提出该实验装置不够完善,应在A、B之间添加一个装有碱石灰的干燥装置。你的意见是 (填“需要”或“不需要”)
(2)为使测定结果尽可能精确,实验中应注意的问题是(要求写出二点) 、
(三)丙组:实验方案:12 g镁铝合金
操作l包括过滤、洗涤、干燥和称量,并最终得到固体物质1.45g。则该合金中铝的质量分数为 。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com