
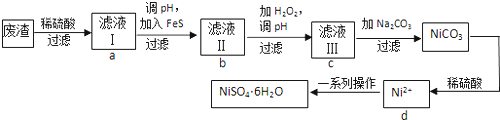
分析 废渣(除含镍外,还含有Cu、Zn、Fe等元素的化合物杂质),在硫酸溶解后过滤后除去不溶性物质,滤液Ⅰ含有二价铁离子、镍离子、锌离子等杂质,加入硫化钠可除去铜离子、锌离子,然后加H2O2是将二价铁氧化成三价铁,调节溶液PH使三价铁以氢氧化物的沉淀而除去,滤液Ⅲ含有可溶性硫酸盐,为Na2SO4、NiSO4,再加碳酸钠沉淀二价镍,过滤、洗涤,然后与硫酸反应生成NiSO4晶体,
(1)FeS除去Cu2+的反应是沉淀的转化;
(2)①对滤液Ⅱ加H2O2的目的是将Fe2+氧化Fe3+;
②然后调pH沉淀Fe3+,Fe3++3H2O?Fe(OH)3+3H+,依据水解平衡常数Kh=$\frac{{c}^{3}({H}^{+})c(Fe(OH)_{3})}{c(F{e}^{3+})}$=$\frac{{c}^{3}({H}^{+})c(Fe(OH)_{3})}{c(F{e}^{3+})}$×($\frac{c(O{H}^{-})}{c(O{H}^{-})}$)3=$\frac{(Kw)^{3}}{Ksp}$计算得到;
③依据铁离子遇到KSCN溶液呈红色设计实验检验是否除净;
(3)NiSO4与Na2CO3反应生成NiCO3沉淀,而后过滤,再加适量稀硫酸溶解又生成NiSO4,这样可提高NiSO4的浓度,有利于蒸发结晶;
(4)①得到的NiSO4溶液经过蒸发浓缩、冷却结晶、过滤等;
②为了提高产率,过滤后得到的母液要循环使用,应该回流到流程中d中;
③产品的纯度不够需要重新溶解、浓缩、结晶析出得到较纯净的晶体.
解答 解:废渣(除含镍外,还含有Cu、Zn、Fe等元素的化合物杂质),在硫酸溶解后过滤后除去不溶性物质,滤液Ⅰ含有二价铁离子、镍离子、锌离子等杂质,加入硫化钠可除去铜离子、锌离子,然后加H2O2是将二价铁氧化成三价铁,调节溶液PH使三价铁以氢氧化物的沉淀而除去,滤液Ⅲ含有可溶性硫酸盐,为Na2SO4、NiSO4,再加碳酸钠沉淀二价镍,过滤、洗涤,然后与硫酸反应生成NiSO4晶体,
(1)FeS除去Cu2+的反应是沉淀的转化,即FeS+Cu2+=CuS+Fe2+,故答案为:FeS+Cu2+=CuS+Fe2+;
(2)①对滤液Ⅱ加H2O2的目的是将Fe2+氧化Fe3+,加入H2O2的离子方程式为:2Fe2++H2O2+2H+=2Fe3++2H2O,故答案为:2Fe2++H2O2+2H+=2Fe3++2 H2O;
②调滤液ⅡpH的目的是除去Fe3+,Fe3++3H2O?Fe(OH)3+3H+,依据水解平衡常数Kh=$\frac{{c}^{3}({H}^{+})c(Fe(OH)_{3})}{c(F{e}^{3+})}$=$\frac{{c}^{3}({H}^{+})c(Fe(OH)_{3})}{c(F{e}^{3+})}$×($\frac{c(O{H}^{-})}{c(O{H}^{-})}$)3=$\frac{(Kw)^{3}}{Ksp}$=$\frac{(1{0}^{-14})^{3}}{2.8×1{0}^{-39}}$≈3.6×10-4;
故答案为:3.6×10-4;
③检验Fe3+是否除尽的操作和现象是用试管取少量滤液Ⅲ,滴加几滴KSCN溶液,若无颜色变化,则Fe3+已除净;
故答案为:用试管取少量滤液Ⅲ,滴加几滴KSCN溶液,若无颜色变化,则Fe3+已除净;
(3)NiSO4与Na2CO3反应生成NiCO3沉淀,而后过滤,再加适量稀硫酸溶解又生成NiSO4,这样可提高NiSO4的浓度,有利于蒸发结晶;
故答案为:增大NiSO4的浓度,利于蒸发结晶(或富集NiSO4);
(4)①得到的NiSO4溶液经过蒸发浓缩、冷却结晶、过滤等;
故答案为:蒸发浓缩、冷却结晶、过滤;
②为了提高产率,过滤后得到的母液要循环使用,应该回流到流程中d中循环使用,
故答案为:d;
③产品的纯度不够需要重新溶解、浓缩、结晶析出得到较纯净的晶体,实验操作为重结晶;
故答案为:重结晶.
点评 本题考查物质的分离提纯的实验方案的设计,侧重于学生的分析能力和实验能力的考查,题目难度较大,明确实验的目的和原理是解答该题的关键,注意把握基本实验操作.


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:选择题
| A. | 氧化铜与稀硫酸反应:O2-+2H+═H2O | |
| B. | Na投入水中:Na+H2O═Na++OH-+H2↑ | |
| C. | 铜与浓硝酸的反应:Cu+4H++2NO3-═Cu2++2NO2↑+2H2O | |
| D. | 氢氧化钡与稀硫酸的反应:H++2SO42-+2Ba2++OH-═2BaSO4↓+H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 加热蒸发食盐水可以得到 NaCl 晶体,加热蒸发 AlCl 3 溶液也可以得到 AlCl 3 晶体 | |
| B. | 配制浓度均为 0.1mol•L-1 的H3PO4 和 H2SO4 溶液,分别测其pH,若 H3PO 4溶液的pH大于 H2SO4 溶液的pH,可推出非金属性:S>P | |
| C. | NaHCO3 溶液中滴入酚酞显红色,NaHSO4 溶液中滴入酚酞也显红色 | |
| D. | 钠在氧气中燃烧生成过氧化钠,和钠同主族的锂在氧气中燃烧也生成过氧化锂 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 铁能被磁体吸引,纯铁易生锈 | |
| B. | FeCl2可以通过铁与氯气的化合反应得到 | |
| C. | 缺铁性贫血里的铁是指铁元素 | |
| D. | 工业上常用铁矿石与氢气在高炉内反应来炼铁 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 Na2S2O3俗称大苏打(海波)是重要的化工原料.用Na2SO3和硫粉在水溶液中加热反应,可以制得Na2S2O3.已知10℃和70℃时,Na2S2O3在100g水中的溶解度分别为60.0g和212g.常温下,从溶液中析出的晶体是Na2S2O3•5H2O.
Na2S2O3俗称大苏打(海波)是重要的化工原料.用Na2SO3和硫粉在水溶液中加热反应,可以制得Na2S2O3.已知10℃和70℃时,Na2S2O3在100g水中的溶解度分别为60.0g和212g.常温下,从溶液中析出的晶体是Na2S2O3•5H2O.| 滴定次数 | 滴定前读数(mL) | 滴定滴定后读数(mL) |
| 第一次 | 0.30 | 31.12 |
| 第二次 | 0.36 | 31.56 |
| 第三次 | 1.10 | 31.88 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | CH3OH的燃烧热为1452kJ•mol-1 | |
| B. | 2H2(g)+O2(g)═2H2O(g)△H>-571.6kJ•mol-1 | |
| C. | 2CH3OH(l)+O2(g)═2CO2(g)+4H2(g)△H=-880.4kJ•mol-1 | |
| D. | CH3COOH(aq)+NaOH(aq)═H2O(l)+CH3COONa(aq)△H=-57.3kJ•mol-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
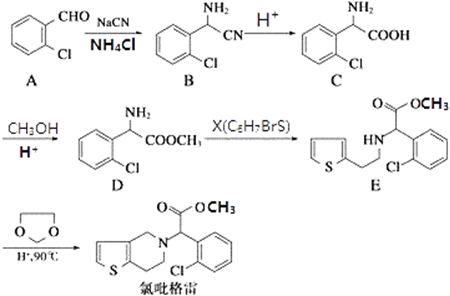

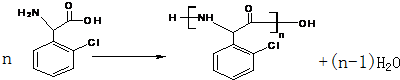 .(不需要写反应条件)
.(不需要写反应条件) ②
②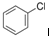 中氯原子较难水解,物质A(
中氯原子较难水解,物质A(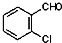 )可由2-氯甲苯为原料制得,写出以两步制备A的化学方程式
)可由2-氯甲苯为原料制得,写出以两步制备A的化学方程式 、
、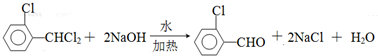 .
.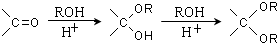
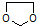 的合成路线流程图(无机试剂任选).合成路线流程图示例如下:CH3CH2OH$→_{170℃}^{浓硫酸}$CH2=CH2
的合成路线流程图(无机试剂任选).合成路线流程图示例如下:CH3CH2OH$→_{170℃}^{浓硫酸}$CH2=CH2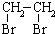
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | a>b>c | B. | b>a>c | C. | c>b>a | D. | b>c>a |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 给试管里的液体加热,液体的体积一般不超过试管容积的$\frac{1}{2}$ | |
| B. | 向酒精灯里添加酒精,不可超过酒精灯容积的$\frac{2}{3}$ | |
| C. | 酒精灯使用完毕,应立即用嘴吹灭火焰 | |
| D. | 用燃着的酒精灯去点燃另一盏酒精灯 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com