

| 0.032mol��3 |
| 4mol/L |



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
| ѡ�� | A | B | C | D |
| ʵ�� | 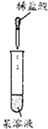 | 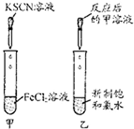 |  | 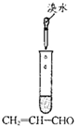 |
| ���� | ���ְ�ɫ���� | �ס�������Һ��δ��� | ���в���ɫ���ױ�����ɫ | ��Һ��ɫ |
| ���� | ԭ��Һ���ܺ�Ag+��SiO32- | ��ˮ��������SCN- | �ױ��м��ױ����� | ��֤�������к�̼̼˫�� |
| A��A | B��B | C��C | D��D |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�


| ʱ�䣨min�� | 0 | 2 | 4 | 6 | 8 |
| c��HI��mol?L-1 | 8.0 | 5.0 | 3.0 | 2.0 | 2.0 |
| c��H2��mol?L-1 | 0 |

�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
| ѡ�� | ʵ����� | ʵ������ | ���� |
| A | ȡ�����ʵ��������ֽ�������X��Y�ֱ������������ᷴӦ | X���������������Y�� | �����ԣ�X��Y |
| B | ����м��ȵ�AgNO3��Һ�еμ�KCl��Һ | ��Һ�ɺ�ɫ��Ϊ��ɫ | KCl��Һ���м��� |
| C | ��CuSO4��Һ�м���KI��Һ���ڼ��뱽���� | �а�ɫ�������ɣ�������Ϻ�ɫ | ��ɫ��������ΪCuI |
| D | ȡ���õ�Na2O2��ĩ�������еμӹ��������� | ������ɫ���� | Na2O2û�б��� |
| A��A | B��B | C��C | D��D |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
| A������������ˮ�ȷ�Ӧʱ�ƾ�����ԭ������������ʲ��뷴Ӧʱ�������ʾ�����ԭ�� |
| B�����ܴ�����ͭ��Һ���û���ͭ������Ҳ�ܴ�����ͭ��Һ���û���ͭ |
| C��̼������������ȼ������CO���ڹ���������ȼ������CO2������������������ȼ������SO2���ڹ���������ȼ������SO3 |
| D��������������ȼ������Al2O3������˿��������ȼ������Fe2O3 |
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com