
| A. | 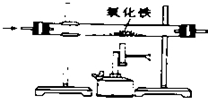 除去CO中的CO2 除去CO中的CO2 | B. | 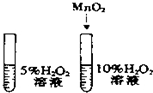 探究二氧化锰对反应速率的影响 探究二氧化锰对反应速率的影响 | ||
| C. | 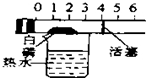 探究空气中氧气的含量 探究空气中氧气的含量 | D. | 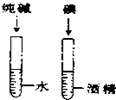 探究溶解性的影响因素 探究溶解性的影响因素 |
分析 A.CO与氧化铁反应生成铁和二氧化碳,会把原物质除去;
B.探究二氧化锰对反应速率的影响,需要控制过氧化氢溶液的浓度相同;
C.白磷燃烧产生固体,根据气体变化的体积差可以计算氧气的含量;
D.溶质不同来验证溶质的影响,不能达到目的.
解答 解:A.一氧化碳与氧化铁反应生成铁和二氧化碳,反而会把原物质除去,不符合除杂原则,故A错误;
B.探究二氧化锰对反应速率的影响时,需要控制过氧化氢溶液的浓度相同,然后一个加入二氧化锰,一个不加二氧化锰,图中过氧化氢溶液的浓度不同,故B错误;
C.白磷燃烧产生固体,使注射器内的气压变小,根据气体变化的体积差可以计算氧气的含量,故C正确;
D.探究溶解性的影响因素时,两支试管内都应放碘,一支试管内放水,一支试管内放酒精,看溶剂的影响;或通过放入溶剂相同,溶质不同来验证溶质的影响,不能达到目的,故D错误;
故选C.
点评 本题考查了化学实验方案的设计与评价,题目难度中等,明确常见实验装置及其应用方法为解答关键,注意掌握常见实验原理及操作方法,试题培养了学生的分析能力及化学实验能力.


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:选择题
| A. | 氯化铁溶液加热蒸干最终得不到氯化铁固体 | |
| B. | 用热的纯碱溶液清洗油污效果好 | |
| C. | 在H2、I2和HI组成的平衡体系加压后,混合气体颜色变深 | |
| D. | 常温下,将1 mL pH=3的醋酸溶液加水稀释至100 mL,测得其pH<5 |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 将BaSO4放入水中不能导电,所以硫酸钡不是电解质 | |
| B. | NaCl溶液能导电,所以NaCl溶液是电解质 | |
| C. | 氯化氢溶于水能导电,但液态氯化氢不能导电 | |
| D. | 固态的NaCl不导电,熔融态NaCl可以导电 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | SO2、CO2、SiO2中的S、C、Si均为sp3杂化 | |
| B. | SO32-、CO32-、SiO32-均为平面三角形 | |
| C. | H3O+、NH4+、[Cu(NH3)4]2+均含有配位键 | |
| D. | 石墨、新型高分子导电材料聚乙炔、金属晶体均含有金属键 |
查看答案和解析>>
科目:高中化学 来源: 题型:推断题
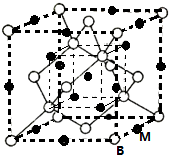 已知A、B、C、D、E、F都是周期表中前四周期的元素,它们的核电荷数依次增大.其中基态A原子价电子排布式为nsnnpn;化合物B2E为离子化合物,E原子核外的M层中只有两对成对电子;C元素基态原子没有不成对电子;D单质常用于制作太阳能电池和集成电路芯片;F原子最外层只有1个电子,其余各内层轨道均充满电子.请根据以上信息,回答下列问题(答题时,A、B、C、D、E、F用所对应的元素符号表示):
已知A、B、C、D、E、F都是周期表中前四周期的元素,它们的核电荷数依次增大.其中基态A原子价电子排布式为nsnnpn;化合物B2E为离子化合物,E原子核外的M层中只有两对成对电子;C元素基态原子没有不成对电子;D单质常用于制作太阳能电池和集成电路芯片;F原子最外层只有1个电子,其余各内层轨道均充满电子.请根据以上信息,回答下列问题(答题时,A、B、C、D、E、F用所对应的元素符号表示):查看答案和解析>>
科目:高中化学 来源: 题型:实验题
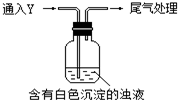 某校探究性活动小组的同学对Na2SO3与AgNO3在不同的pH条件下的反应原理进行实验探究,请你一起参与探究活动并回答有关问题:
某校探究性活动小组的同学对Na2SO3与AgNO3在不同的pH条件下的反应原理进行实验探究,请你一起参与探究活动并回答有关问题:| 实验 | pH | 实 验 现 象 |
| a | 10 | 产生白色沉淀,稍后溶解,溶液澄清 |
| b | 6 | 产生白色沉淀,一段时间后,沉淀未溶解 |
| c | 2 | 产生大量白色沉淀,一段时间后,产生海绵状棕黑色物质X |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 过量CO2通入溶液中:2NaCN+H2O+CO2=2HCN+Na2CO3 | |
| B. | 经测定CH3COONH4的水溶液呈中性可知:K(NH3•H2O)=1.75×10-5 | |
| C. | 将等物质的量浓度的CH3COONa与NaCN溶液等体积混合后的溶液中:c(CH3COO-)>c(CN-) | |
| D. | 常温下将10ml的PH=3的醋酸溶液稀释到100ml,其PH<4 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 0.1s | B. | 2.5s | C. | 5s | D. | 10s |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com