
【题目】乙烯催化氧化成乙醛可设计成如下图所示的燃料电池,能在制备乙醛的同时获得电能,其总反应为:2CH2=CH2+ O2→2CH3CHO。下列有关说法正确的是
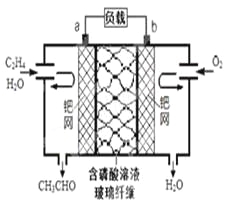
A. 该电池为可充电电池
B. 每有0.1mol O2反应,则迁移H+ 0.4mol
C. 正极反应式为:CH2=CH2-2e-+ 2OH-→CH3CHO + H2O
D. 电子移动方向:电极a→磷酸溶液→电极b
科目:高中化学 来源: 题型:
【题目】BF3是典型的平面三角形分子,它溶于氢氟酸或NaF溶液中都形成BF4-离子,则BF3和BF4-中的B原子的杂化轨道类型分别是
A. sp2、sp2B. sp3、sp3C. sp2、sp3D. sp、sp2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知下列原子的半径:
原子 | N | S | O | Si |
半径r/10-10 m | 0.75 | 1.02 | 0.74 | 1.17 |
根据以上数据,P原子的半径可能是( )
A.1.10×10-10 mB.1.08×10-10 m
C.1.20×10-10 mD.0.70×10-10 m
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图装置(Ⅰ)为一种可充电电池的示意图,其中的离子交换膜只允许K+通过,该电池放电、充电的化学方程式为2K2S2+KI3![]() K2S4 +3KI。装置(Ⅱ)为电解池的示意图,当闭合开关K时,电极X附近溶液先变红。则闭合K时,下列说法不正确的是( )
K2S4 +3KI。装置(Ⅱ)为电解池的示意图,当闭合开关K时,电极X附近溶液先变红。则闭合K时,下列说法不正确的是( )

A. K+从左到右通过离子交换膜 B. 电极A上发生的反应为I3-+2e-=3I-
C. 电极Y上发生的反应为2Cl--2e-=Cl2↑ D. 当有0.1 molK+通过离子交换膜,X电极上产生1.12L气体(标准状况)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列溶液中微粒的物质的量浓度关系正确的是
A. 25℃时,向0.1mol·L-1NH4HSO4溶液中滴加NaOH溶液至中性:c(Na+)>c(NH4+)>c(SO42-)>c(OH-)=c(H+)
B. 25℃时,NaB溶液的pH=8,c(Na+)- c(B-)=9.9×10-7 mol·L-1
C. 0.1 mol·L-1NaHCO3溶液:c(Na+)>c(oH-)>c(HCO3-)>c(H+)
D. 相同物质的量浓度的CH3COONa和NaClO的混合液中,各离子浓度的大小关系是:c(Na+)>c(ClO-)>c(CH3COO-)>c(OH-)>c(H+)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)CO2是温室气体,可用NaOH溶液吸收得到Na2CO3或NaHCO3。Na2CO3俗称纯碱,已知25℃时,CO32-第一步水解的平衡常数Kh=2×10-4mol/L,当溶液中c(HCO3-):c(CO32-)=20∶ 1 时,溶液的pH=______。
(2)为了除去银器表面Ag2S,可采用如下方法:在一个铝制的容器中放入食盐溶液,将银器浸入食盐溶液,使银器与铝接触良好形成原电池.过一段时间,银器表面变为银白色,并闻到臭鸡蛋的气味,观察到有少量白色絮状沉淀生成,则原电池的正极反应为______________________________,请解释臭鸡蛋气味形成的原因(用离子方程式表示)________________________________________。

(3)25 ℃,在0.10 mol·L-1H2S溶液中,通入HCl气体或加入NaOH固体以调节溶液pH,溶液pH与c(S2-)关系如图(忽略溶液体积的变化、H2S的挥发)。
①pH=11时,溶液中的c(H2S)+c(HS-)=________mol·L-1。
②某溶液含0.040 mol·L-1M2+、0.10 mol·L-1H2S,当溶液pH=________时,Mn2+开始沉淀。[已知:Ksp(MS)=5.6×10-17]
(4)Na2S2O3溶液常作为标准液测定物质的组成。
I.取3.92 g某铁的氧化物,溶于足量稀硫酸,并配制成100.0 mL溶液;
II.取10.00 mL所得溶液,加入足量KI溶液,滴加几滴指示剂;
III.用0.2000 mol L-1的Na2S2O3标准溶液滴定,重复2~3次,平均消耗标准液20.00mL。
已知:I2+2S2O32-= S4O62-+2I-。则:
①步骤II 所用指示剂的名称为____________;判断达到滴定终点的操作和现象___________________。
②该铁的氧化物的化学式为______________。
(5)常温下,向20 mL 0.2 mol /L H2A溶液中滴加0.2 mol /L NaOH溶液。有关微粒的物质的量变化如上图,其中三条线代表的是A2-、H2A和HA-浓度变化的曲线,根据图示,当V(NaOH)=20 mL时,溶液中Na+、HA-、 A2-、 H2A四种微粒浓度大小关系:__________________________________。溶液显_______性。

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是
A. C2H2分子中σ键与π键的数目比为1:1且σ键比π键重叠程度大,形成的共价键强
B. SO2和CS2均为V形的极性分子
C. ①H3O+ ②[Cu(NH3)4]2+ ③CH3COO- ④NH3 ⑤CH4中存在配位键的是①②⑤
D. SiF4和SO32-的中心原子均为sp3杂化
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com