
| A. | 16.8g | B. | 22.4g | C. | 21g | D. | 19.6g |
分析 n[Cu(NO3)2]=4mol/L×0.1L=0.4mol,用惰性电极电解该溶液时,阳极反应式为2H2O--4e-=O2↑+4H+,则收集的n(O2)=$\frac{1.12L}{22.4L/mol}$=0.05mol,转移电子物质的量=4n(O2)=4×0.05mol=0.2mol,假设铜离子完全析出转移电子物质的量=2n(Cu 2+)=2n[Cu(NO3)2]=2×0.4mol=0.8mol>0.2mol,所以铜离子部分析出,根据2H2O--4e-=O2↑+4 H+得n(H+)=4n(O2)=0.2mol,Fe和硝酸反应方程式为3Fe+8HNO3=3Fe(NO3)2+2NO↑+4H2O,根据硝酸和Fe之间的关系式计算酸溶解铁的质量;铁还和铜离子发生置换反应生成亚铁离子,根据剩余铜离子计算铜离子消耗铁的质量,这两部分消耗铁的质量为总的消耗铁质量.
解答 解:n[Cu(NO3)2]=4mol/L×0.1L=0.4mol,用惰性电极电解该溶液时,阳极反应式为2H2O--4e-=O2↑+4H+,则收集的n(O2)=$\frac{1.12L}{22.4L/mol}$=0.05mol,转移电子物质的量=4n(O2)=4×0.05mol=0.2mol,假设铜离子完全析出转移电子物质的量=2n(Cu 2+)=2n[Cu(NO3)2]=2×0.4mol=0.8mol>0.2mol,所以铜离子部分析出,根据2H2O--4e-=O2↑+4 H+得n(H+)=4n(O2)=0.2mol,Fe和硝酸反应方程式为3Fe+8HNO3=3Fe(NO3)2+2NO↑+4H2O,根据3Fe+8HNO3=3Fe(NO3)2+2NO↑+4H2O得溶解n(Fe)=$\frac{3}{8}$n(HNO3)=$\frac{3}{8}$×0.2mol=0.075mol,则酸溶解m(Fe)=0.075mol×56g/mol=4.2g;
铜离子和Fe发生置换反应生成Cu,根据转移电子守恒得发生置换反应消耗n(Fe)=n[Cu(NO3)2]=0.4mol-$\frac{0.2mol}{2}$=0.3mol,溶解m(Fe)=56g/mol×0.3mol=16.8g,
所以消耗铁的总质量=4.2g+16.8g=21g,故选C.
点评 本题以电解原理为载体考查化学方程式有关计算,正确判断各个电极上发生的反应是解本题关键,注意阴极析出物质成分的判断,要熟练运用转移电子守恒、原子守恒,很多同学往往漏掉Fe和铜离子的置换反应而导致错误,为易错题.


 能力评价系列答案
能力评价系列答案 唐印文化课时测评系列答案
唐印文化课时测评系列答案 导学与测试系列答案
导学与测试系列答案科目:高中化学 来源: 题型:选择题
| A. | 酸性溶液中可能大量存在Fe2+、Cl?、NO3?、Na+ | |
| B. | 无色溶液中可能大量存在Mg2+、NH4+、Cl?、SO42- | |
| C. | 强碱性溶液中可能大量存在NH4+、K+、Cl?、SO42? | |
| D. | 酸性溶液中可能大量存在Fe3+、K+、I?、SO42- |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
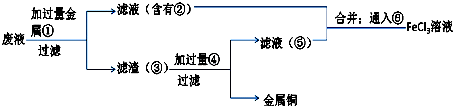
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 卤代反应 | B. | 加聚反应 | C. | 酯化反应 | D. | 消去反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
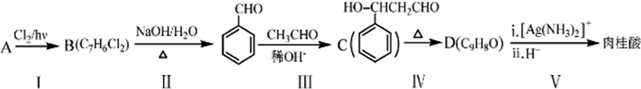

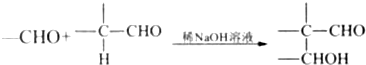
 .
. .肉桂酸的同分异构体中,符合下列条件的有3种,其中在1H核磁共振谱图中出现信号峰数量最少的异构体的结构简式是
.肉桂酸的同分异构体中,符合下列条件的有3种,其中在1H核磁共振谱图中出现信号峰数量最少的异构体的结构简式是 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 充电时阳极反应:NiOOH+H2O+e-═Ni(OH)2+OH- | |
| B. | 充电过程是电能转化为化学能的过程 | |
| C. | 放电时负极附近溶液的碱性不变 | |
| D. | 放电时电解质溶液中的OH-向正极移动 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 根据是否含有氧元素,将物质分为氧化剂和还原剂 | |
| B. | 根据是否具有丁达尔现象,将分散系分为溶液、胶体和浊液 | |
| C. | 根据水溶液是否能够导电,将物质分为电解质和非电解质 | |
| D. | 根据反应前后是否有元素化合价变化,可将化学反应分为氧化还原反应和非氧化还原反应 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com