
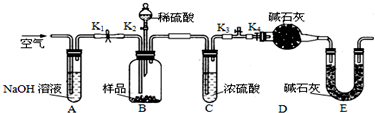
| n |
| 44 |
mg-
| ||
| mg |
m-
| ||
| m |
m-
| ||
| m |


 轻松暑假总复习系列答案
轻松暑假总复习系列答案科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| NaOH/H2O |
| △ |
 水杨酸酯E为紫外线吸收剂,可用于配制防晒霜.E的一种合成路线如下:
水杨酸酯E为紫外线吸收剂,可用于配制防晒霜.E的一种合成路线如下:
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、已知Ce原子序数是58,则其为镧系元素 | ||||||||
B、铈有四种稳定的核
| ||||||||
| C、用Ce(SO4)2溶液可与硫酸亚铁溶液反应,其离子方程式为:Ce4++2Fe2+=Ce3++2Fe3+ | ||||||||
| D、铈溶于氢碘酸的化学方程式可表示为:Ce+4HI=CeI4+2H2↑ |
查看答案和解析>>
科目:高中化学 来源: 题型:

| 称量次序 | 加热温度(℃) | 容器+试样质量(g) |
| Ⅰ | 常温 | 62.2 |
| Ⅱ | T1 | 56.8 |
| Ⅲ | T2 | 49.6 |
| Ⅳ | T3 | 44.2 |
| Ⅴ | T4 | 44.2 |
查看答案和解析>>
科目:高中化学 来源: 题型:
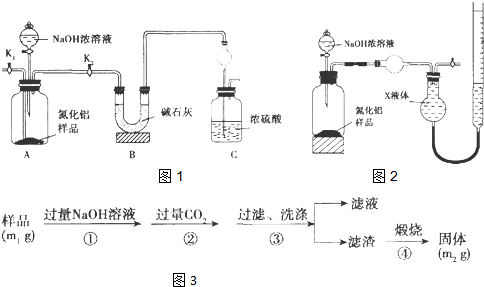

查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、Na2CO3溶液中:c(Na+)=c(HCO3-)+c(CO32-)+c(H2CO3) |
| B、25℃,pH=7的NH3?H2O和NH4Cl的混合溶液中:c(Cl-)=c(NH4+)>c(H+)=c(OH-) |
| C、CH3COONa溶液中:c(Na+)>c(CH3COO -)>c(H+)>c(OH-) |
| D、NaHCO3溶液中:c(Na+)+c(H+)=c(OH-)+c(CO32-)+c(HCO3-) |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、丙烯分子有7个δ键,1个π键 |
| B、丙烯分子中3个碳原子都是sp3杂化 |
| C、丙烯分子中所有原子在同一平面上 |
| D、丙烯能使酸性高锰酸钾褪色 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com