
 HCO3-+OH-;
HCO3-+OH-;分析 (1)FeC在足量的空气中高温煅烧,生成有磁性的固体Y,Y为Fe3O4,与过量的盐酸反应生成氯化亚铁、氯化铁,溶液有剩余的HCl;硝酸具有强氧化性,Fe3O4与过量的浓硝酸反应生成硝酸铁;
(2)加入过量的NaOH,Al3+转化为偏铝酸根,Mg2+、Fe2+、Cu2+转化为氢氧化物沉淀,且氢氧化亚铁易被氧化,灼烧固体得到氧化镁、氧化铜、氧化铁,用过量的稀盐酸中,所得溶液中含有Mg2+、Fe3+、Cu2+;
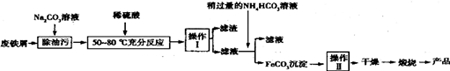
(3)由制备流程可知,碳酸钠水解显碱性,可促进油污的水解,加稀硫酸除去碳酸钠,且溶解Fe,操作I为过滤,滤液中含Fe2+,与碳酸氢铵反应生成碳酸亚铁沉淀,操作II为洗涤,然后干燥、灼烧得到氧化铁,相对误差为相对值除以准确值.
解答 解:(1)FeC在足量的空气中高温煅烧,生成有磁性的固体Y,Y为Fe3O4,溶于过量的盐酸反应生成氯化亚铁、氯化铁,溶液有剩余的HCl,溶液中大量存在的阳离子是Fe2+、Fe3+、H+,硝酸具有强氧化性,Fe3O4与过量的浓硝酸反应生成硝酸铁;
故答案为:Fe3O4+8HCl═2FeCl3+FeCl2+4H2O;
(2)加入过量的NaOH,Al3+转化为偏铝酸根,Mg2+、Fe2+、Cu2+转化为氢氧化物沉淀,且氢氧化亚铁易被氧化,灼烧固体得到氧化镁、氧化铜、氧化铁,用过量的稀盐酸中,所得溶液中含有Mg2+、Fe3+、Cu2+,与原溶液相比,溶液中大量减少的阳离子是Al3+、Fe2+,
故选BC;
(3)①Na2CO3溶液可以除油污,油污在碱性条件下生成可溶解的钠盐和醇,原因是碳酸钠溶液水解呈碱性,故答案为:CO32-+H2O?HCO3-+OH-;
②由上述分析可知,操作II为洗涤,操作Ⅱ的方法为在漏斗中加入适量蒸馏水,浸没沉淀,让蒸馏水自然流下,重复2~3次,
故答案为:向漏斗中加入蒸馏水至没过固体,让水自然流出,重复2~3次;
③生成FeCO3沉淀的离子方程式为Fe2++2HCO3-═FeCO3↓+CO2↑+H2O,故答案为:Fe2++2HCO3-═FeCO3↓+CO2↑+H2O;
④相对误差为(1.000-1.015)÷1.015═-1.48%,(1.015-1.000)÷1.015=+1.48%,
故答案为:±1.5%(±1.48% ).
点评 本题考查元素化合物性质、化学工艺流程、基本操作与方案设计、盐类水解、常用化学用语等,物质的制备实验及混合物分离提纯方法选择,为高频考点,注意把握流程中发生的反应、混合物分离方法等,侧重分析与应用能力的考查,难度中的,是对所学知识的综合利用.


 英语小英雄天天默写系列答案
英语小英雄天天默写系列答案 暑假作业安徽少年儿童出版社系列答案
暑假作业安徽少年儿童出版社系列答案科目:高中化学 来源: 题型:选择题
| A. | K+、Na+、HCO3-、SO42- | B. | K+、Cu2+、Cl-、NO3- | ||
| C. | NH4+、Al3+、Br-、SO42- | D. | Na+、Ba2+、Cl-、NO3- |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 向Na2S03溶液中加入硝酸酸化的BaCl2,有白色沉淀出现,说明Na2S03溶液已经变质 | |
| B. | 在海轮外壳上镶入锌块,可减缓船体的腐蚀速率 | |
| C. | 等体积、pH都为3的酸HCl和CH3COOH分别与足量的锌反应,放出的氢气一样多 | |
| D. | 硫酸铁可用于净水,因为三价铁离子可水解生成Fe(OH)3沉淀 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
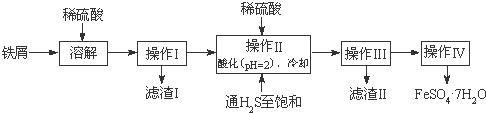
| 饱和H2S溶液 | SnS沉淀完全 | FeS开始沉淀 | FeS沉淀完全 | |
| pH值 | 3.9 | 1.6 | 3.0 | 5.5 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | CH4(g)+2N02(g)═N2(g)+C02(g)+2H2O(l)△H=-867 kJ.mol-1 | |
| B. | CH4催化还原1molNOx为N2的过程中,若x=1.5,则转移的电子总数为3×6.02×1021 | |
| C. | 若0.2 mol CH4还原N02至N2,在上述条件下吸收眵热迸为173.4 kJ | |
| D. | 若用4.48 LCH4还原N02至N2,整个过程中转移电子总数为1.6×6.02×1021 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com