
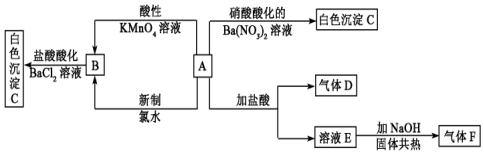
 A、B、C是中学化学中常见的三种物质,它们之间的相互转化关系如图(部分反应条件及产物略去):
A、B、C是中学化学中常见的三种物质,它们之间的相互转化关系如图(部分反应条件及产物略去):分析 (1)A是一种金属,C是淡黄色固体,则A为Na,B为Na2O,C为Na2O2;
(2)A是一种非金属,其单质为黑色固体,C是最主要的温室气体,则A为碳,B为CO,C为二氧化碳.
解答 解:(1)A是一种金属,C是淡黄色固体,则A为Na,B为Na2O,C为Na2O2,A→C反应的化学方程式为2Na+O2$\frac{\underline{\;\;△\;\;}}{\;}$Na2O2,Na2O2与水反应生成NaOH和氧气,离子反应为2Na2O2+2H2O═4Na++4OH-+O2↑,
故答案为:Na2O;2Na+O2$\frac{\underline{\;\;△\;\;}}{\;}$Na2O2;2Na2O2+2H2O═4Na++4OH-+O2↑;
(2)A是一种非金属,其单质为黑色固体,C是最主要的温室气体,则A为碳,B为CO,C为CO2,A和C反应的化学方程式为:C+CO2$\frac{\underline{\;高温\;}}{\;}$2CO,
故答案为:CO2;能;C+CO2$\frac{\underline{\;高温\;}}{\;}$2CO.
点评 本题考查无机物的推断,为高频考点,侧重考查学生的分析能力,难度不大,注意根据物质的颜色进行推断,熟需要学生练掌握元素化合物知识.


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:填空题
 (1)在298K时,1molCH4在氧气中完全燃烧生成二氧化碳和液态水,放出热量890.0kJ.写出该反应的热化学方程式CH4(g)+2O2(g)═CO2(g)+2H2O(l)△H=-890.0kJ/mol.现有CH4和CO的混合气体0.75mol,完全燃烧后,生成CO2气体和18克液态水,并放出515kJ热量,则CH4和CO的物质的量分别为0.5mol、0.25mol.
(1)在298K时,1molCH4在氧气中完全燃烧生成二氧化碳和液态水,放出热量890.0kJ.写出该反应的热化学方程式CH4(g)+2O2(g)═CO2(g)+2H2O(l)△H=-890.0kJ/mol.现有CH4和CO的混合气体0.75mol,完全燃烧后,生成CO2气体和18克液态水,并放出515kJ热量,则CH4和CO的物质的量分别为0.5mol、0.25mol.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
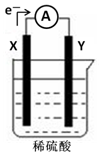 如图,在盛有稀硫酸的烧杯中放入用导线连接的电极X、Y,外电路中电子流向如图所示,关于该装置的下列说法正确的是( )
如图,在盛有稀硫酸的烧杯中放入用导线连接的电极X、Y,外电路中电子流向如图所示,关于该装置的下列说法正确的是( )| A. | 溶液中电子流向Y→X | |
| B. | 若两电极分别为铁和碳棒,则X为碳棒,Y为铁 | |
| C. | X极上发生的是还原反应,Y极上发生的是氧化反应 | |
| D. | 若两电极都是金属,则它们的活动性顺序为X>Y |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
 ;写出蓝色沉淀溶解在氨水中的离子方程式Cu(OH)2+4NH3•H2O=[Cu(NH3)4]2++2OH-+4H2O.
;写出蓝色沉淀溶解在氨水中的离子方程式Cu(OH)2+4NH3•H2O=[Cu(NH3)4]2++2OH-+4H2O.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 0.01 mol/L | B. | 0.015 mol/L | C. | 0.017 mol/L | D. | 0.05 mol/L |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
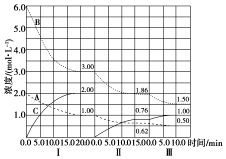 已知某放热热反应在1L的密闭容器中进行反应.保持容器体积不变,改变其他反应条件,在Ⅰ、Ⅱ、Ⅲ阶段体系中各气体物质浓度随时间变化的曲线如图所示:
已知某放热热反应在1L的密闭容器中进行反应.保持容器体积不变,改变其他反应条件,在Ⅰ、Ⅱ、Ⅲ阶段体系中各气体物质浓度随时间变化的曲线如图所示:查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com