
由熔盐电解法获得的粗铝含一定量的金属钠和氢气,这些杂质可采用吹气精炼法除去,产生的尾气经处理后可用于钢材镀铝。工艺流程如下:
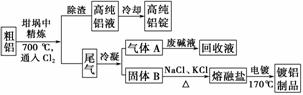
(注:NaCl熔点为801 ℃;AlCl3在181 ℃升华)
(1)精炼前,需清除坩埚表面的氧化铁和石英砂,防止精炼时它们分别与铝发生置换反应产生新的杂质,相关的化学方程式为①____________________________________________________________和
②____________________________________________________________。
(2)将Cl2连续通入坩埚中的粗铝熔体,杂质随气泡上浮除去。气泡的主要成分除Cl2外还含有________;固态杂质粘附于气泡上,在熔体表面形成浮渣,浮渣中肯定存在________。
(3)在用废碱液处理气体A的过程中,所发生反应的离子方程式为____________________________________________________________。
(4)镀铝电解池中,金属铝为________极,熔融盐电镀液中铝元素和氯元素主要以AlCl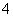 和Al2Cl
和Al2Cl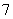 形式存在,铝电极的主要电极反应式为____________________________________________________________。
形式存在,铝电极的主要电极反应式为____________________________________________________________。
(5)钢材镀铝后,表面形成的致密氧化铝膜能防止钢材腐蚀,其原因是____________________________________________________________。
解析 (1)铝属于活泼金属。在高温下可置换某些金属或非金属,因此有关反应的方程式为2Al+Fe2O3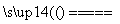 Al2O3+2Fe、4Al+3SiO2
Al2O3+2Fe、4Al+3SiO2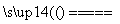 2Al2O3+3Si;(2)在高温下,氯气可与氢气、金属钠和铝反应生成HCl、NaCl和AlCl3,由于温度是700 ℃,所以AlCl3会升华变成气体,因此气泡的主要成分除Cl2外还含有HCl和AlCl3;NaCl熔点为801 ℃,此时NaCl不会熔化,只能在浮渣中存在,即浮渣中肯定存在NaCl;(3)尾气经冷凝后分为气体A和固体B,由框图可知A是氯气和氯化氢的混合气体,B是AlCl3,因此用废碱液处理A的过程中,所发生反应的离子方程式为Cl2+2OH-===Cl-+ClO-+H2O和H++OH-===H2O;(4)既然是镀铝,所以铝必须作阳极,由于熔融盐中铝元素和氯元素主要以AlCl
2Al2O3+3Si;(2)在高温下,氯气可与氢气、金属钠和铝反应生成HCl、NaCl和AlCl3,由于温度是700 ℃,所以AlCl3会升华变成气体,因此气泡的主要成分除Cl2外还含有HCl和AlCl3;NaCl熔点为801 ℃,此时NaCl不会熔化,只能在浮渣中存在,即浮渣中肯定存在NaCl;(3)尾气经冷凝后分为气体A和固体B,由框图可知A是氯气和氯化氢的混合气体,B是AlCl3,因此用废碱液处理A的过程中,所发生反应的离子方程式为Cl2+2OH-===Cl-+ClO-+H2O和H++OH-===H2O;(4)既然是镀铝,所以铝必须作阳极,由于熔融盐中铝元素和氯元素主要以AlCl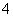 和Al2Cl
和Al2Cl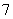 形式存在,所以阳极的电极反应式为Al+4Cl--3e-===AlCl
形式存在,所以阳极的电极反应式为Al+4Cl--3e-===AlCl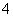 ,2Al+7Cl--6e-===Al2Cl
,2Al+7Cl--6e-===Al2Cl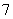 ;(5)铝在空气中易形成一层致密而坚固的氧化膜,它能阻止内部的金属继续被氧化,起到防腐蚀保护作用。
;(5)铝在空气中易形成一层致密而坚固的氧化膜,它能阻止内部的金属继续被氧化,起到防腐蚀保护作用。
答案 (1)①2Al+Fe2O3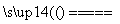 Al2O3+2Fe ②4Al+3SiO2
Al2O3+2Fe ②4Al+3SiO2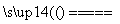 2Al2O3+3Si
2Al2O3+3Si
(2)HCl和AlCl3 NaCl
(3)Cl2+2OH-===Cl-+ClO-+H2O,H++OH-===H2O
(4)阳 Al+4Cl--3e-===AlCl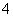 ,2Al+7Cl--6e-===Al2Cl
,2Al+7Cl--6e-===Al2Cl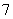
(5)氧化铝膜能隔绝空气,阻碍铜铁被腐蚀


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:
NaHSO3溶液的pH<7,NaHCO3溶液的pH>7,下列说法错误的是( )
A.HSO3-的电离作用大于HSO3-的水解作用
B.HSO3-的电离作用小于HSO3-的水解作用
C.HCO3-的电离作用大于HCO3-的水解作用
D.HCO3-的电离作用小于HCO3-的水解作 用
用
查看答案和解析>>
科目:高中化学 来源: 题型:
分子式为C7H8的某有机物,它能使酸性高锰酸钾溶液褪色,但不能与溴水反应。在一定条件下与H2完全加成,加成后其一氯代物的同分异构体有( )。
A.3种 B.4种
C.5种 D.6种
查看答案和解析>>
科目:高中化学 来源: 题型:
为了探究新制饱和氯水的组成和性质而进行了如下科学实验:先观察了氯水的外观性质以后,再用胶头滴管将该氯水逐滴滴入含有酚酞的NaOH溶液中,边滴边振荡,并连续观察现象,发现溶液的红色逐渐褪去而得无色溶液。请回答下列问题:
(1)写出新制饱和氯水中含有氯元素物质的化学式:
__________________________________________。
(2)若不再进行更多的实验,请说明能快速判断氯水中含有Cl2的主要依据:____________________。
(3)根据预测,实验中溶液红色褪去的原因可能有两种,请用简要的文字说明:
①__________________________________________。
②__________________________________________。
(4)通过实验进一步探究溶液红色褪去的原因究竟是上述中的①还是②。
[实验步骤]
①取试管内的无色溶液3 mL盛于另一支洁净的试管中;
②________________,振荡试管。
[实验现象及结论]
①若________________,则证明溶液红色褪去的原因是①而不是②;
②若________________,则证明溶液红色褪去的原因是②而不是①。
查看答案和解析>>
科目:高中化学 来源: 题型:
FeCl3在现代工业生产中应用广泛。某化学研究性学习小组模拟工业流程制备无水FeCl3,再用副产品FeCl3溶液吸收有毒的H2S。
Ⅰ.经查阅资料得知:无水FeCl3在空气中易潮解,加热易升华。他们设计了制备无水FeCl3的实验方案,装置示意图(加热及夹持装置略去)及操作步骤如下:
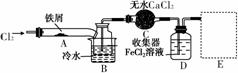
①检验装置的气密性;
②通入干燥的Cl2,赶尽装置中的空气;
③用酒精灯在铁屑下方加热至反应完成;
④……
⑤体系冷却后,停止通入Cl2,并用干燥的N2赶尽Cl2,将收集器密封。
请回答下列问题:
(1)装置A中反应的化学方程式为____________________________________________________________。
(2)第③步加热后,生成的烟状FeCl3大部分进入收集器,少量沉积在反应管A右端。要使沉积的FeCl3进入收集器,第④步操作是____________________________________________________________。
(3)操作步骤中,为防止FeCl3潮解所采取的措施有(填步骤序号)____________。
(4)装置B中冷水浴的作用为____________________________________________________________;
装置C的名称为________;装置D中FeCl2全部反应后,因失去吸收Cl2的作用而失效,写出检验FeCl2是否失效的试剂:____________________________________________________________。
(5)在虚线框中画出尾气吸收装置E并注明试剂。
Ⅱ.该组同学用装置D中的副产品FeCl3溶液吸收H2S,得到单质硫;过滤后,再以石墨为电极,在一定条件下电解滤液。
(6)FeCl3与H2S反应的离子方程式为____________________________。
(7)电解池中H+在阴极放电产生H2,阳极的电极反应式为____________________________。
(8)综合分析实验Ⅱ的两个反应,可知该实验有两个显著优点:
①H2S的原子利用率为100%;
②____________________________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
反应速率v和反应物浓度的关系是用实验方法测定的。化学反应H2+Cl2===2HCl的反应速率v可表示为v=k[H2]m[Cl2]n,式中k为常数,m、n值可用下表中数据确定。
| [H2]/mol·L-1 | [Cl2]/ mol·L-1 | v/mol·L-1·s-1 |
| 1.0 | 1.0 | 1.0 k |
| 2.0 | 1.0 | 2.0 k |
| 2.0 | 4.0 | 4.0 k |
由此可推得,m、n值正确的是( )
A.m=1、n=1 B.m=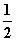 、n=
、n=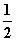
C.m=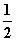 、n=1 D.m=1、n=
、n=1 D.m=1、n=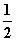
查看答案和解析>>
科目:高中化学 来源: 题型:
已知:Na2S2O3+H2SO4===Na2SO4+SO2↑+S↓+H2O,下列各组实验中,反应速率最快的是( )
| 组号 | 反应温度/℃ | Na2S2O3 | H2SO4 | H2O | ||
| 体积/ mL | 浓度/ mol·L-1 | 体积/ mL | 浓度/ mol·L-1 | 体积/ mL | ||
| A | 10 | 5 | 0.2 | 5 | 0.1 | 10 |
| B | 10 | 5 | 0.1 | 5 | 0.1 | 10 |
| C | 30 | 5 | 0.1 | 5 | 0.1 | 10 |
| D | 30 | 5 | 0.2 | 5 | 0.2 | 10 |
查看答案和解析>>
科目:高中化学 来源: 题型:
某温度下,在体积为2 L的密闭容器中充入1 mol A和b mol B气体,发生如下反应:A(g)+B(g)
 2C(g),5 min后反应达平衡时n(A)为0.4 mol。在反应过程中体系的温度持续升高,实验测得混合气体中C的含量与温度的关系如下图所示。下列叙述正确的是( )
2C(g),5 min后反应达平衡时n(A)为0.4 mol。在反应过程中体系的温度持续升高,实验测得混合气体中C的含量与温度的关系如下图所示。下列叙述正确的是( )
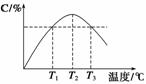
A.0~5 min,C物质的平均反应速率为0.04 mol·L-1·min-1
B.图中温度T1时的正反应速率等于温度T3时的正反应速率
C.该反应温度T2时的平衡常数大于温度T3时的平衡常数
D.图中T2时,若只增大压强,则正、逆反应速率不改变
查看答案和解析>>
科目:高中化学 来源: 题型:
我国有丰富的锆英石资源,其主要成分是ZrSiO4,还含有Al2O3、SiO2、Fe2O3等杂质,生产锆的流程之一如下:
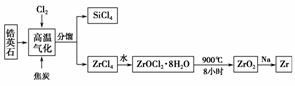
已知:锆(Zr)合金是核反应堆燃料棒的包裹材料,二氧化锆(ZrO2)可以制造耐高温纳米陶瓷。
(1)上述流程中高温气化的反应是氧化还原反应(碳转化成CO),其中氧化剂是________,转移1.204×1024个电子时,生成SiCl4________g。
(2)写出ZrCl4与水反应的化学方程式:______________________,写出ZrOCl2·8H2O在900℃条件下分解的化学方程式:____________________________________。
3下列关于二氧化锆纳米陶瓷和锆合金的说法不正确的是 。
A.1 nm=10-10 m
B.锆合金的硬度比纯锆要高,C.二氧化锆纳米陶瓷是新型无机非金属材料
4一种新型燃料电池,一极通入空气,另一极通入丁烷;电解质是掺杂氧化钇Y2O3的氧化锆ZrO2晶体,在熔融状态下能传导O2-。在熔融电解质中,O2-向 填“正”或“负”极移动。电池的负极反应式为 。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com