
|
下列离子在溶液中因发生氧化还原反应而不能大量共存的是 | |
A. |
H+ |
B. |
Ag+ |
C. |
K+ Ba2+ OH- |
D. |
Cu2+ |
 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:阅读理解
| 481a |
| 304 |
| 481a |
| 304 |
查看答案和解析>>
科目:高中化学 来源: 题型:阅读理解
(14分)
I(8分)用如图所示装置进行实验,将A中液体加入到B中,在甲装置内制备某种气体,在乙装置对甲中产生的气体进行性质实验。
(1)若要检查甲装置的气密性,具体的操作步骤为 。
(2)若在分液漏斗A中盛浓盐酸:
①若B中盛有某种紫黑色固体,C中盛有KI淀粉溶液,旋开F.E后,C中的溶液变蓝色,则B中固体为 ;继续通气体于C中,足够长的时间后,发现C中溶液蓝色褪去,这是因为在溶液中的I2被氧化为HIO3,写出此反应的化学方程式 。
②若B中盛有某种无色液体,当C中盛石蕊试液时,旋开F.E后,C中的溶液变红色,当C中盛品红溶液时,旋开F.E后,品红溶液不褪色,则B中无色液体为 。
当C中盛![]() 溶液时,写出C中反应的化学方程式 。但我们发现在将A中液体加入圆底烧瓶中速度过快会有危险,你认为应如何简单的改进该装置就能避免该危险: 。
溶液时,写出C中反应的化学方程式 。但我们发现在将A中液体加入圆底烧瓶中速度过快会有危险,你认为应如何简单的改进该装置就能避免该危险: 。
Ⅱ(6分)氢气在空气中燃烧生成水:但有的同学会提出:氢气在空气中燃烧会不会生成H2O2;根据我们的经验,H2O2不稳定,即便是有少量H2O2生成,也会因火焰的高温而分解。某课外兴趣小组利用上题中的甲装置设计了如下图所示装置验证H2在空气中燃烧的产物中是否含有H2O2。试填空:
(1)甲同学从下列试剂中选择了一种检验试剂,成功检测到了H2O2的存在,该试剂是
A.淀粉溶液 B.氯化钠溶液
C.氢氧化钠溶液 D.淀粉碘化钾酸性溶液
甲同学检验时证明H2O2产生的实验现象是
反应的离子方程式为 。
(2)乙同学用较稀的酸性高锰酸钾溶液作为检验试剂,实验时观察到高锰酸钾溶液褪色(生成Mn2+),由此也证明了氢气燃烧有H2O2,写出该反应的离子方程式:
。
查看答案和解析>>
科目:高中化学 来源:2011届湖南嘉禾一中高三1月份高考押题化学试卷 题型:实验题
(14分)
I(8分)用如图所示装置进行实验,将A中液体加入到B中,在甲装置内制备某种气体,在乙装置对甲中产生的气体进行性质实验。
(1)若要检查甲装置的气密性,具体的操作步骤为 。
(2)若在分液漏斗A中盛浓盐酸:
①若B中盛有某种紫黑色固体,C中盛有KI淀粉溶液,旋开F.E后,C中的溶液变蓝色,则B中固体为 ;继续通气体于C中,足够长的时间后,发现C中溶液蓝色褪去,这是因为在溶液中的I2被氧化为HIO3,写出此反应的化学方程式 。
②若B中盛有某种无色液体,当C中盛石蕊试液时,旋开F.E后,C中的溶液变红色,当C中盛品红溶液时,旋开F.E后,品红溶液不褪色,则B中无色液体为 。
当C中盛 溶液时,写出C中反应的化学方程式 。但我们发现在将A中液体加入圆底烧瓶中速度过快会有危险,你认为应如何简单的改进该装置就能避免该危险: 。
溶液时,写出C中反应的化学方程式 。但我们发现在将A中液体加入圆底烧瓶中速度过快会有危险,你认为应如何简单的改进该装置就能避免该危险: 。
Ⅱ(6分)氢气在空气中燃烧生成水:但有的同学会提出:氢气在空气中燃烧会不会生成H2O2;根据我们的经验,H2O2不稳定,即便是有少量H2O2生成,也会因火焰的高温而分解。某课外兴趣小组利用上题中的甲装置设计了如下图所示装置验证H2在空气中燃烧的产物中是否含有H2O2。试填空:
(1)甲同学从下列试剂中选择了一种检验试剂,成功检测到了H2O2的存在,该试剂是
| A.淀粉溶液 | B.氯化钠溶液 |
| C.氢氧化钠溶液 | D.淀粉碘化钾酸性溶液 |
查看答案和解析>>
科目:高中化学 来源:2010-2011学年湖南嘉禾一中高三1月份高考押题化学试卷 题型:实验题
(14分)
I(8分)用如图所示装置进行实验,将A中液体加入到B中,在甲装置内制备某种气体,在乙装置对甲中产生的气体进行性质实验。

(1)若要检查甲装置的气密性,具体的操作步骤为 。
(2)若在分液漏斗A中盛浓盐酸:
①若B中盛有某种紫黑色固体,C中盛有KI淀粉溶液,旋开F.E后,C中的溶液变蓝色,则B中固体为 ;继续通气体于C中,足够长的时间后,发现C中溶液蓝色褪去,这是因为在溶液中的I2被氧化为HIO3,写出此反应的化学方程式 。
②若B中盛有某种无色液体,当C中盛石蕊试液时,旋开F.E后,C中的溶液变红色,当C中盛品红溶液时,旋开F.E后,品红溶液不褪色,则B中无色液体为 。
当C中盛 溶液时,写出C中反应的化学方程式
。但我们发现在将A中液体加入圆底烧瓶中速度过快会有危险,你认为应如何简单的改进该装置就能避免该危险:
。
溶液时,写出C中反应的化学方程式
。但我们发现在将A中液体加入圆底烧瓶中速度过快会有危险,你认为应如何简单的改进该装置就能避免该危险:
。
Ⅱ(6分)氢气在空气中燃烧生成水:但有的同学会提出:氢气在空气中燃烧会不会生成H2O2;根据我们的经验,H2O2不稳定,即便是有少量H2O2生成,也会因火焰的高温而分解。某课外兴趣小组利用上题中的甲装置设计了如下图所示装置验证H2在空气中燃烧的产物中是否含有H2O2。试填空:

(1)甲同学从下列试剂中选择了一种检验试剂,成功检测到了H2O2的存在,该试剂是
A.淀粉溶液 B.氯化钠溶液
C.氢氧化钠溶液 D.淀粉碘化钾酸性溶液
甲同学检验时证明H2O2产生的实验现象是
反应的离子方程式为 。
(2)乙同学用较稀的酸性高锰酸钾溶液作为检验试剂,实验时观察到高锰酸钾溶液褪色(生成Mn2+),由此也证明了氢气燃烧有H2O2,写出该反应的离子方程式:
。
查看答案和解析>>
科目:高中化学 来源: 题型:阅读理解
I用如图所示装置进行实验,将A中液体加入到B中,在甲装置内制备某种气体,在乙装置对甲中产生的气体进行性质实验。
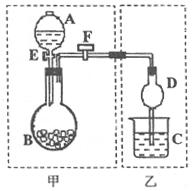
(1)若要检查甲装置的气密性,具体的操作步骤为 。
(2)若在分液漏斗A中盛浓盐酸:
①若B中盛有某种紫黑色固体,C中盛有KI淀粉溶液,旋开F.E后,C中的溶液变蓝色,则B中固体为 ;继续通气体于C中,足够长的时间后,发现C中溶液蓝色褪去,这是因为在溶液中的I2被氧化为HIO3,写出此反应的化学方程式 。
②若B中盛有某种无色液体,当C中盛石蕊试液时,旋开F.E后,C中的溶液变红色,当C中盛品红溶液时,旋开F.E后,品红溶液不褪色,则B中无色液体为 。
当C中盛![]() 溶液时,写出C中反应的化学方程式 。但我们发现在将A中液体加入圆底烧瓶中速度过快会有危险,你认为应如何简单的改进该装置就能避免该危险: 。
溶液时,写出C中反应的化学方程式 。但我们发现在将A中液体加入圆底烧瓶中速度过快会有危险,你认为应如何简单的改进该装置就能避免该危险: 。
Ⅱ氢气在空气中燃烧生成水:但有的同学会提出:氢气在空气中燃烧会不会生成H2O2;根据我们的经验,H2O2不稳定,即便是有少量H2O2生成,也会因火焰的高温而分解。某课外兴趣小组利用上题中的甲装置设计了如下图所示装置验证H2在空气中燃烧的产物中是否含有H2O2。试填空:
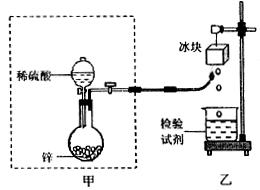
(1)甲同学从下列试剂中选择了一种检验试剂,成功检测到了H2O2的存在,该试剂是
A.淀粉溶液 B.氯化钠溶液
C.氢氧化钠溶液 D.淀粉碘化钾酸性溶液
甲同学检验时证明H2O2产生的实验现象是
反应的离子方程式为 。
(2)乙同学用较稀的酸性高锰酸钾溶液作为检验试剂,实验时观察到高锰酸钾溶液褪色(生成Mn2+),由此也证明了氢气燃烧有H2O2,写出该反应的离子方程式:
。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com