
【题目】用NA表示阿伏加德罗常数的值。下列说法正确的是
A.常温下,56g铁片投入足量浓H2SO4中,充分反应,生成NA个SO2分子
B.向100mL 1mol·L-1Fe(NO3)3溶液中滴加足量HI溶液,转移0.1NA个电子
C.4.6 g SO2和CO2的混合气体含有的电子数为2.3NA
D.120g NaHSO4固体中阳离子和阴离子的总数为3NA
【答案】C
【解析】
A.常温下,铁片投入足量浓H2SO4中发生钝化,铁表面生成致密的氧化膜,阻止反应继续进行,无法计算,故A错误;
B.向100mL 1mol·L-1Fe(NO3)3溶液中滴加足量HI溶液,酸性条件下,硝酸根离子具有强氧化性,碘离子具有还原性,故铁离子与硝酸根离子都可被碘离子还原,发生氧化还原反应,Fe3++3NO3+12H++10I═Fe2++5I2+3NO↑+6H2O,氧化剂是铁离子和硝酸根离子,铁离子化合价从+3价降低到+2价,硝酸根的氮原子从+5价降低到+2价,有三个氮原子化合价降低,共降低了1+3×3=10,故当0.1mol硝酸铁完全反应后,转移1mol电子即NA个,故B错误;
C.4.6g SO2和CO2的摩尔质量之比等于电子数之比,均为16: 11,故两者的一定质量的混合物中,无论两者的比例如何,虽然混合物的物质的量不是定值,但含有的电子数为定值,即可设混合物全部是CO2,则4.6g CO2的物质的量为n=![]() =0.1045mol,故含有的电子的物质的量n=0.1045mol×22=2.3mol,即为2.3NA个,故C正确;
=0.1045mol,故含有的电子的物质的量n=0.1045mol×22=2.3mol,即为2.3NA个,故C正确;
D.120gNaHSO4的物质的量n=![]() =1mol,而1molNaHSO4固体中含1mol钠离子和1molHSO4,故含2mol离子即2NA个,故D错误;
=1mol,而1molNaHSO4固体中含1mol钠离子和1molHSO4,故含2mol离子即2NA个,故D错误;
答案选C。


科目:高中化学 来源: 题型:
【题目】有机物 W 在医药和新材料等领域有广泛应用。W 的一种合成路线如图:
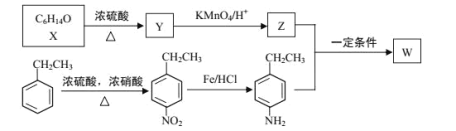
已知部分信息如下:
① | 1molY完全反应生成2molZ,且在加热条件下Z不能和新制氢氧化铜悬浊液反应 |
② |
|
③ | RCH2NH2+ |
请回答下列问题:
(1)Y 的化学名称是___;Z 中官能团的名称是___;
(2)![]() 中_____________(填“有”或“无”)手性碳原子;图示中 X 转化为 Y 的反应类型是___。
中_____________(填“有”或“无”)手性碳原子;图示中 X 转化为 Y 的反应类型是___。
(3)生成 W 的化学方程式为___。
(4)G 是对硝基乙苯的同分异构体,G 能和碳酸钠反应产生气体且分子中含有—NH2(氨基),G的同分异构体有___种(不考虑立体结构),其中在核磁共振氢谱上峰的面积比为 1∶2∶2∶2∶2 的结构简式为_________________。
(5)设计以苯乙烯和丙酮为原料制备药物中间体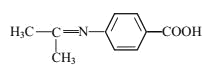 的合成路线__________(无机试剂自选)。
的合成路线__________(无机试剂自选)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列离子方程式书写正确的是( )
A.向NaHSO4溶液中滴加Ba(OH)2溶液至溶液呈中性: H++SO42-+Ba2++OH-=BaSO4↓+H2O
B.在酸性碘化钾溶液中滴加双氧水:2I-+2H++H2O2=I2+2H2O
C.向NaAlO2溶液中通入过量CO2:2AlO![]() +3H2O+CO2=2Al(OH)3↓+CO
+3H2O+CO2=2Al(OH)3↓+CO![]()
D.向稀HNO3中滴加Na2SO3溶液:SO![]() +2H+=SO2↑+H2O
+2H+=SO2↑+H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】X、Y、Z、W是中学化学常见的四种物质,他们之间具有如图所示转化关系,则下列组合不可能的是

X | Y | Z | W | |
A | C | CO | CO2 | O2 |
B | Na | Na2O | Na2O2 | O2 |
C | AlCl3 | Al(OH)3 | NaAl(OH)4 | NaOH |
D | Fe | FeCl2 | FeCl3 | Cl2 |
A. AB. BC. CD. D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有一无色透明溶液,欲确定是否含有下列离子:
Na+、Mg2+、Al3+、Fe2+、Ba2+、NO![]() 、SO
、SO![]() 、Cl-、SO32-、HCO
、Cl-、SO32-、HCO![]() ,取该溶液进行以下实验:
,取该溶液进行以下实验:
①取少量待测液,加入几滴石蕊试液,溶液呈红色。
②取少量待测液,浓缩后加入铜片和浓硫酸,加热,有无色气体产生,此无色气体遇空气变成红棕色。
③取少量待测液,加入BaCl2溶液,有白色沉淀产生。
④取实验③中上层清液滴加AgNO3溶液,有白色沉淀产生,此沉淀不溶于稀硝酸。
⑤另取少量原溶液滴加NaOH溶液,有白色沉淀产生,当NaOH过量时,沉淀部分溶解。
(1)根据以上实验,溶液中肯定存在的离子是_________________;肯定不存在的离子是______________;尚不能确定的离子是_______________。
(2)写出②中有关反应的离子方程式:________________________________________。
(3)写出⑤中沉淀溶解的离子方程式:________________________________________。
(4)实验室检验Na+一般用焰色反应即可确定,此实验做之前要用______清洗铂丝。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用石油和煤可以得到有机化工生产中需要的众多原料,例如由石油得到的乙烯和由煤得到的苯可制聚苯乙烯。生产过程如下:
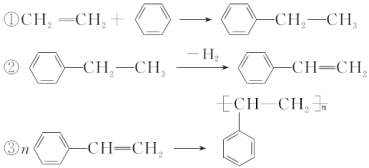
下列说法不正确的是( )
A. 通过裂解可以从石油中获得更多的乙烯
B. 通过煤的干馏不能直接得到纯净的苯
C. 制聚苯乙烯的反应①为加成反应
D. 反应①②③的原子利用率都达到了100%
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某同学设计如下实验装置探究硫酸与金属、非金属的反应、验证其产物,并探究随着反应的进行,硫酸性质发生的变化。根据实验要求回答相关问题:

F装置用于检验二氧化碳。供选择的试剂有:只含碳的生铁、18 mol·L-1的硫酸、品红溶液、无水硫酸铜粉未、酸性高锰酸钾溶液、氧化铜、澄清的石灰水、碱石灰。(供选择的试剂可重复使用)
(1)打开分液漏斗的活塞,A装置中发生的反应6H2SO4(浓)+2Fe![]() Fe2(SO4)3+6H2O↑+3SO2↑和(用化学方程式表示)_____,随反应的进行,硫酸的浓度变稀,又发生反应(用化学方程式表示)____
Fe2(SO4)3+6H2O↑+3SO2↑和(用化学方程式表示)_____,随反应的进行,硫酸的浓度变稀,又发生反应(用化学方程式表示)____
(2)B装置中的试剂是__________。
(3)E装置中的试剂是____________作用是______________。
(4)G装置中的试剂是__________,现象是______________。
(5)制备SO2的适宜药品为___________(填代号)。
①Na2SO3固体;②Na2SO3溶液;③20%硫酸;④70%硫酸;⑤铜片
(6)对SO2与氯水的反应进行探究。用注射器吸入一定量的饱和氯水和SO2,振荡,静置,再吸入少量品红溶液,发现品红溶液不褪色,用化学反应方程式解释其原因____________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知:
①向KMnO4晶体滴加浓盐酸,产生黄绿色气体;
②FeCl2溶液中通入少量实验①产生的气体,溶液变黄色;
③实验②生成的溶液滴在KI试纸上,试纸变蓝
下列判断正确的是( )
A.上述实验证明氧化性:![]() >Cl2>Fe3+>I2
>Cl2>Fe3+>I2
B.上述实验中共有两个氧化还原反应
C.实验①生成的气体不能使湿润的KI试纸变蓝
D.实验②证明Fe2+既有氧化性又有还原性
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】A是化学实验室中最常见的有机物,易溶于水有特殊香味,并能进行如图所示的多种反应。
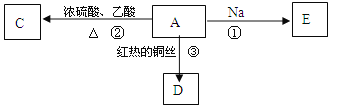
(1)物质A和C的结构简式A___________;C_____________________。
(2)反应②的类型____________________________。
(3)反应①的化学反应方程式 _______________________。
(4)反应③的化学反应方程式 ________________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com