
| A. | 用惰性电极电解饱和氯化钠溶液:2Cl-+2H+ $\frac{\underline{\;电解\;}}{\;}$H2↑+Cl2↑ | |
| B. | 用醋酸除去水垢:CaCO3+2H+═Ca2++H2O+CO2↑ | |
| C. | 利用腐蚀法制作印刷线路板:2Fe3++Cu═2Fe2++Cu2+ | |
| D. | 实验室用液溴和苯在催化剂作用下制溴苯: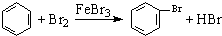 |
分析 A.电解饱和食盐水生成氯气和氢气,氢氧化钠,离子方程式水不能拆开;
B.醋酸为弱酸,应写成化学式;
C.根据离子方程式原子守恒、电荷也守恒判断;
D.液溴与苯在催化剂条件下发生取代反应生成溴苯和HBr.
解答 解:A.电解饱和食盐水生成氯气和氢气,氢氧化钠,反应式为2Cl-+2H2O $\frac{\underline{\;电解\;}}{\;}$H2↑+Cl2↑+2OH-,离子方程式水不能拆开,故A错误;
B.醋酸为弱酸,应写成化学式,正确的离子方程式为CaCO3+2CH3COOH=2CH3COO-+Ca2++H2O+CO2↑,故B错误;
C.该离子方程式原子守恒、电荷也守恒,故C正确;
D.液溴与苯在催化剂条件下发生取代反应生成溴苯和HBr,反应的方程式为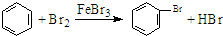 ,故D正确.
,故D正确.
故选CD.
点评 本题考查离子方程式以及化学方程式的书写,题目难度不大,本题注意离子的检验方法,离子方程式中的弱电解质、电荷守恒等问题.


 千里马走向假期期末仿真试卷寒假系列答案
千里马走向假期期末仿真试卷寒假系列答案科目:高中化学 来源: 题型:选择题
| A. | NA 个氨气分子中含有3mol σ 键 | |
| B. | 18g水中含有NA 对孤电子对 | |
| C. | NA 个氮气分子中含有2mol π键 | |
| D. | NA 个二氧化碳分子中含有2mol π键 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
 四种短周期元素X、Y、Z、W在元素周期表中的相对位置如图所示,其中Y是地球上含量最高的金属元素.下列判断正确的是( )
四种短周期元素X、Y、Z、W在元素周期表中的相对位置如图所示,其中Y是地球上含量最高的金属元素.下列判断正确的是( )| A. | 1molW的单质在足量空气中燃烧转移电子数是6NA | |
| B. | 含Y元素的盐溶液可能显酸性,也可能显碱性 | |
| C. | Z元素的单质和氧化物不能与任何酸发生反应 | |
| D. | X与H、O元素形成的化合物一定是共价化合物 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 化学式 | 颜色 | Ksp |
| AgCl | 白色 | 2.0×10-10 |
| AgBr | 浅黄色 | 5.4×10-13 |
| AgI | 黄色 | 8.3×10-17 |
| Ag2S | 黑色 | 2.0×10-48 |
| Ag2CrO4 | 红色 | 2.0×10-12 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 乙烯的分子式:CH2=CH2 | |
| B. | NaHCO3的电离:HCO3-+H2O?H3O++CO32- | |
| C. | NaOH的结构式:Na-O-H | |
| D. | NH4Cl的电子式: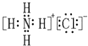 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 族 周期 | I A | ⅡA | ⅢA | ⅣA | VA | ⅥA | ⅦA | 0 |
| 2 | ⑥ | ⑧ | ||||||
| 3 | ① | ③ | ⑤ | ⑦ | ⑩ | |||
| 4 | ② | ④ | ⑨ |
 .
.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com