
分析 根据物质的量浓度为c=$\frac{1000ρw}{M}$进行计算,由此分析解答.
解答 解:w=$\frac{\frac{VL}{22.4L/mol}×Mg•mo{l}^{-}}{1000+\frac{V}{22.4}×Mg}×100%$=$\frac{MV}{22400+MV}$×100%,所以溶液的物质的量浓度为$\frac{1000d×\frac{MV}{22400+MV}}{M}$=$\frac{1000dV}{22400+MV}$mol/L,故答案为:$\frac{1000dV}{22400+MV}$.
点评 本题考查常用化学计量的计算等,难度不大,注意对公式的理解与灵活运用,侧重于考查学生的分析能力和计算能力.


科目:高中化学 来源: 题型:选择题
| A. | 2[SO42-]=[NH4+]>[H+]=[OH-] | B. | [SO42-]>[NH4+]]>[H+]=[OH-] | ||
| C. | [NH4+]]>[SO42-]>c(OH-)>c(H+) | D. | [NH4+]]>[SO42-]>[H+]>[OH-] |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 向浓氢氧化钠溶液中通入少量的CO2气体:CO2+OH-═HCO3- | |
| B. | 过量的NaHSO4溶液与Ba(OH)2溶液反应:Ba2++OH-+H++SO42-═BaSO4↓+H2O | |
| C. | 澄清石灰水中滴加少量的小苏打溶液:Ca2++OH-+HCO3-═CaCO3↓+H2O | |
| D. | 向Na2S2O3溶液中通入过量的氯气:S2O32-+2Cl-+3H2O═2SO32-+4Cl-+6H+ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ②⑤⑦ | B. | ①②⑦ | C. | ①⑥⑦ | D. | ①⑤⑥ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 2Na2O2+2H2O=4NaOH+O2↑ | B. | 2F2+2H2O=4HF+O2 | ||
| C. | 3NO2+H2O=NO+2HNO3 | D. | 3Fe+4H2O(g)$\frac{\underline{\;\;△\;\;}}{\;}$4H2+Fe3O4 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
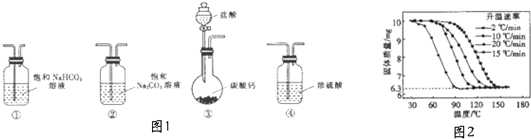
| NaHCO3溶液 BaCl2浓度 | 0.2mol•L-1 | 0.1mol•L-1 | 0.02mol•L-1 |
| 0.2mol•L-1 | 浑浊 | 浑浊 | 少许浑浊 |
| 0.1mol•L-1 | 浑浊 | 少许浑浊 | 无现象 |
| 0.02mol•L-1 | 少许浑浊 | 无现象 | 无现象 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
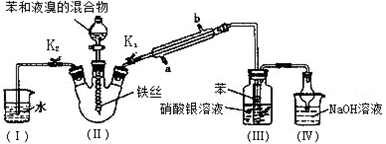
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
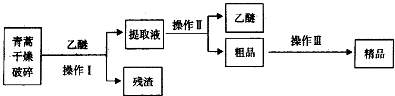
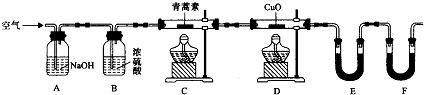
| 装置 | 实验前/g | 试验后/g |
| E | 22.6 | 42.4 |
| F | 80.2 | 146.2 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com