
| A. | 构成原电池的正极和负极必须是两种不同的金属 | |
| B. | 原电池工作时,外电路中电流的流向从原电池负极到原电池正极 | |
| C. | 原电池工作时,电解质溶液中的阴离子向负极移动 | |
| D. | 只要是放热反应就可以将其设计成原电池 |
分析 A、原电池的正极和负极可能是两种不同的金属;
B、原电池中 电子流出的一端电极为负极,电流方向和电子流向相反;
C、原电池工作时,阳离子向正极移动,阴离子向负极移动;
D、只有能自发进行的放热的氧化还原反应才能设计成原电池;
解答 A、电极材料可由金属构成,也可由能导电的非金属和金属材料构成,故A错误;
B、原电池放电,电流从正极流向负极,故B错误;
C、原电池工作时,阳离子向正极移动,阴离子向负极移动,故C正确;
D、只有能自发进行的放热的氧化还原反应才能设计成原电池,并不是所有的氧化还原反应,故D错误;
故选C.
点评 本题考查原电池知识,较为综合,为高频考点,侧重于学生的分析能力的考查,注意把握原电池的工作原理,难度不大,注意相关基础知识的积累.


 导学与测试系列答案
导学与测试系列答案 新非凡教辅冲刺100分系列答案
新非凡教辅冲刺100分系列答案科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 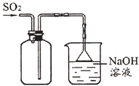 收集SO2 收集SO2 | |
| B. | 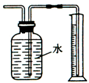 测量Cu与浓硝酸反应产生气体的体积反应 测量Cu与浓硝酸反应产生气体的体积反应 | |
| C. | 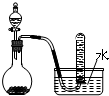 二氧化锰固体和双氧水制取O2 二氧化锰固体和双氧水制取O2 | |
| D. |  吸收HCl 吸收HCl |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 乙醇和乙酸的酯化反应不属于取代反应 | |
| B. | 煤的干馏是物理变化 | |
| C. | 戊烷的同分异构体有三种 | |
| D. | 蛋白质、淀粉、油脂均属于天然高分子化合物 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 增大反应物浓度 | B. | 加压 | C. | 升温 | D. | 加催化剂 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | c (Na+)=c (HB-)+2 c (B2-)+c (H2B) | B. | c(Na+)=0.01 mol/L≥c (B2-) | ||
| C. | c (H+)•c (OH-)=10-14 | D. | c (Na+)+c (H+)=c(HB-)+c (B2-)+c (OH-) |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 碱性氧化物:氧化铁(Fe3O4) | B. | 酸性氧化物:二氧化碳(CO2) | ||
| C. | 碱性氧化物:(Na2O2) | D. | 碱:纯碱(Na2CO3) |
查看答案和解析>>
科目:高中化学 来源: 题型:计算题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 2,2,3,3-四甲基丁烷 | B. | 3,4-二甲基己烷 | ||
| C. | 2,2,3-三甲基戊烷 | D. | 3-甲基-3-乙基戊烷 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com