
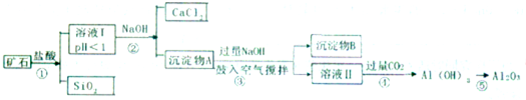


 励耘书业暑假衔接宁波出版社系列答案
励耘书业暑假衔接宁波出版社系列答案科目:高中化学 来源: 题型:
. |
| M |

. |
| M |
查看答案和解析>>
科目:高中化学 来源: 题型:
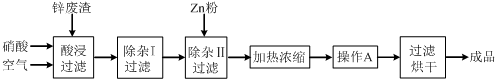
| 氢氧化物 | Al(OH)3 | Fe(OH)3 | Fe(OH)2 | Cu(OH)2 | Zn(OH)2 |
| 开始沉淀的pH | 3.3 | 1.5 | 6.5 | 4.2 | 5.4 |
| 沉淀完全的pH | 5.2 | 3.7 | 9.7 | 6.7 | 8.0 |
查看答案和解析>>
科目:高中化学 来源: 题型:
 电子工业常用30%的FeCl3 溶液腐蚀镀在绝缘板上的铜箔,制造印刷电路板.
电子工业常用30%的FeCl3 溶液腐蚀镀在绝缘板上的铜箔,制造印刷电路板.查看答案和解析>>
科目:高中化学 来源: 题型:
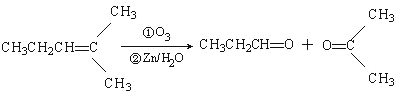

查看答案和解析>>
科目:高中化学 来源: 题型:

| A、O~A段反应的化学方程式是Ba(OH)2+CO2═BaCO3↓+H2O |
| B、A~B段反应的离子方程式是2OH-+CO2═CO32-+H2O |
| C、A~B段与C~D段所发生的反应相同 |
| D、D~E段沉淀的减少是由于碳酸钡固体的溶解所致 |
查看答案和解析>>
科目:高中化学 来源: 题型:
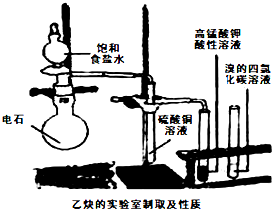
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、②③⑤ | B、①④⑥ |
| C、③④⑤ | D、②④⑥ |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com