
【题目】在密闭容器中某气态烃和氧气按一定比例混和,燃烧后恢复到原温度(20℃),压强减小至原来的一半,若加NaOH溶液气体全部被吸收,则此烃可能为( )
A.C2H4B.C2H6C.C3H6D.CH4
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:
【题目】溶液中除铁时还常用NaClO3作氧化剂,在较小的pH条件下最终生成一种浅黄色的黄铁矾钠 [Na2Fe6(SO4)4(OH)12]沉淀除去。下图是温度-pH与生成的沉淀关系图,图中阴影部分是黄铁矾稳定存在的区域。下列说法不正确的是 {已知25℃,Ksp[Fe(OH)3]=2.64×10-39}
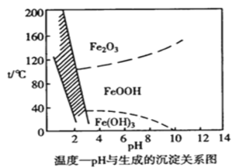
A.工业生产黄铁矾钠,温度控制在85~95℃pH=1.5左右
B.pH=6,温度从80℃升高至150℃体系得到的沉淀被氧化
C.用氯酸钠在酸性条件下氧化Fe2+ 离子方程式为:6Fe2++ClO3-+6H+=6Fe3++Cl-+3H2O
D.在25℃时溶液经氧化,调节溶液pH=4 ,此时溶液中c(Fe3+)=2.64×10-9 mol·L-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】碘酸钾作为食盐—碘添加剂,而碘化钾则是化工生产中一种重要原料。还原法生产碘化钾是由碘与氢氧化钾反应生成碘酸钾后,用甲酸还原而得,其主要流程如图。
请回答下列问题:
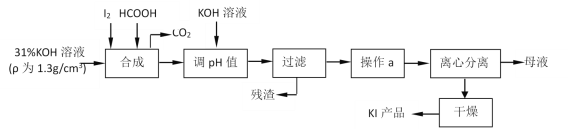
(1)判断“合成”过程中,碘是否已完全反应的方法是___。
(2)实验室中,过滤操作要求“一贴二低三靠”,其中“三靠”是指盛有被过滤液体的烧杯注液口紧靠玻璃棒、___、___。
操作a包括“蒸发浓缩、冷却结晶”是依据KI具有何种性质:___。
(3)写出“合成”过程中,HCOOH参与的离子反应方程式:___。
(4)测定产品中KI含量的方法是:
a.称取3.340g样品、溶解,在250mL容量瓶中定容;
b.量取25.00mL溶液于锥形瓶中,加入足量KIO3,用少量稀硫酸酸化所,使KIO3与KI反应完全;
c.以淀粉为指示剂,用0.2400mol/L的Na2S2O3溶液滴定,消耗溶液体积平均值为10.00mL。
已知:IO3-+I-+H+→I2+H2O(未配平),I2+2S2O32-→2I-+S4O62-。
①测定过程所需仪器在使用前必须检查是否漏液的有___。
②该样品中KI的质量分数为___。(保留3位有效数字)
(5)有学生选用家庭厨房中的有关调料(如黄酒、白醋、酱油、味精等),用简便方法来检测是否是加碘食盐。通过实践,发现厂商只要在食盐包装的封口处夹一条碘化钾淀粉试纸,并在袋上注明使用方法就能鉴别真伪。现请你写出检测使用说明书___。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将有机物完全燃烧,生成CO2和H2O,将12 g该有机物完全燃烧产物通过浓硫酸,浓硫酸增重14.4 g,再通过碱石灰,又增重26.4 g。则该有机物的分子式为( )
A. C4H10 B. C2H6O
C. C3H8O D. C2H4O2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】乙酸和甲酸甲酯互为同分异构体,其结构式分别如下
 和
和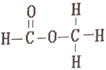
在下列哪种检测仪上显示出的信号是完全相同的
A. 李比希元素分析仪 B. 红外光谱仪
C. 核磁共振仪 D. 质谱仪
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知:pKa= -lgKa,25℃时,H2SO3的pKa1=1.85,pKa2=7.19。常温下,用0.1mol/LNaOH溶液滴定20mL 0.1mol/L H2SO3溶液的滴定曲线如图所示。下列说法不正确的是( )
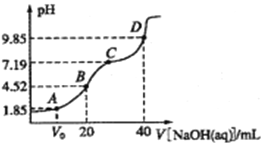
A.A点所得溶液中:Vo等于l0mL
B.B点所得溶液中:c(Na+)+ c(H+)=2c(SO32-)+ c(HSO3-)+ c(OH-)
C.C点所得溶液中:c(Na+)>3c(HSO3-)
D.D点所得溶液中水解平衡常数:Kh1=10-6.81
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】 有机物Y是一种治疗心血管和高血压的药物,某研究小组以甲苯、乙烯等物质为主要原料,通过以下路线合成:
有机物Y是一种治疗心血管和高血压的药物,某研究小组以甲苯、乙烯等物质为主要原料,通过以下路线合成:

已知:RX+NaCN![]() RCN
RCN![]() RCOOH
RCOOH

请回答:
(1)Y的化学式为______________
(2)写出化合物H的结构简式_______________。
(3)下列说法不正确的是______________。
A.B的一氯代物有三种
B.反应①②③④均属于取代反应
C.化合物G→Y的转化过程中,涉及的反应类型有取代反应、加成反应
D.反应①的试剂与条件为Cl2/光照
E. 化合物E能发生银镜反应
(4)写出反应④的化学方程式________________。
(5)芳香族化合物M是B的同分异构体,M含有二个六元环(且两个二元环共用两个相邻的碳原子),则M可能的结构有_______________。(任写两种)
(6)已知一个碳原子上连有两个羟基是不稳定的,会脱水转化为羰基。:![]() .写出以
.写出以![]() 为原料制备合成
为原料制备合成 的线路图。___________
的线路图。___________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】硫酸亚铁(![]() )是一种用途广泛的化工原料,工业上常用废铁屑和稀硫酸制备。
)是一种用途广泛的化工原料,工业上常用废铁屑和稀硫酸制备。
实验室通过图7装置模拟其制备过程。请回答下列问题:
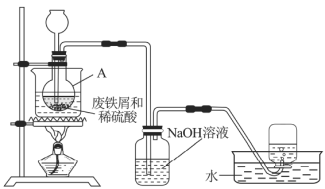
(1)进行实验之前需检查整套装置的______。装置甲中仪器A的名称是______,铁和稀硫酸反应后所得溶液呈______色。
(2)常温下废铁屑和稀硫酸反应较慢,而直接加热时温度过高又可能产生![]() 等副产物,因此,采用水浴加热,并使用过量的
等副产物,因此,采用水浴加热,并使用过量的![]() 将可能产生的
将可能产生的![]() 还原成
还原成![]() 。
。![]() 还原
还原![]() 的离子方程式为______________。
的离子方程式为______________。
(3)为验证反应后A中溶液是否含![]() ,取A中少量溶液快速冷却后,迅速滴入几滴
,取A中少量溶液快速冷却后,迅速滴入几滴![]() 溶液,溶液颜色无明显变化,说明A中溶液__________(填“含有”或“不含”)
溶液,溶液颜色无明显变化,说明A中溶液__________(填“含有”或“不含”)![]() 。
。
(4)废铁屑中含有硫化物杂质,故反应中会生成少量的![]() 气体。因此,装置乙中
气体。因此,装置乙中![]() 溶液的主要作用是______,装置丙中集气瓶收集到的气体主要是________。
溶液的主要作用是______,装置丙中集气瓶收集到的气体主要是________。
(5)将![]() 废铁屑(
废铁屑(![]() 单质的质量分数为80%,杂质为
单质的质量分数为80%,杂质为![]() 和
和![]() )与
)与![]() 的
的![]() 溶液充分反应,
溶液充分反应,![]() 的理论产量为____
的理论产量为____![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)利用反应Cu+2FeCl3=CuCl2+2FeCl2设计成如下图所示的原电池,回答下列问题:
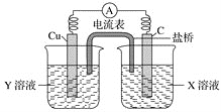
①写出电极反应式:
正极___________;负极__________。
②图中X溶液是________,Y溶液是________。
③原电池工作时,盐桥中的________(填“阳”、“阴”)离子向X溶液方向移动。
(2)控制适合的条件,将反应2Fe3++2I-![]() 2Fe2++I2设计成如图所示的原电池。
2Fe2++I2设计成如图所示的原电池。
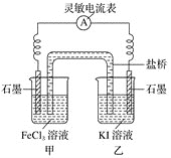
请回答下列问题:
①反应开始时,乙中石墨电极上发生________(填“氧化”或“还原”)反应,电极反应式为________。甲中石墨电极上发生________(填“氧化”或“还原”)反应,电极反应式为______。
②电流表读数为0时,反应达到平衡状态,此时在甲中加入FeCl2固体,则乙中的石墨作________(填“正”或“负”)极,该电极的电极反应式为________。
(3)利用反应2Cu+O2+2H2SO4=2CuSO4+2H2O可制备CuSO4,若将该反应设计为原电池,其正极电极反应式为________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com