
分析 (1)同种非金属元素之间形成非极性共价键,不同种非金属元素之间形成极性共价键;
(2)过氧化氢分子间,氧原子和氢原子间易形成氢键,氢键的存在使物质的熔沸点较高;
(3)稀硫酸与Ba02反应来生成H2 O2和硫酸钡沉淀;
(4)根据碳酸酸性大于H2O2,Na2O2与干燥的CO2不反应,知应是水和CO2生成碳酸,依据强酸制弱酸的原理,碳酸再与Na2O2反应生成H2O2;H2O2不稳定,发生了分解;
(5)高锰酸钾酸性溶液氧化过氧化氢为氧气,高锰酸根离子被还原为锰离子,结合反应的定量关系计算元过氧化氢的浓度.
解答 解:(1)H2O2中H原子和O原子之间存在极性共价键、O原子和O原子之间只存在非极性共价键;
故答案为:极性键、非极性键;
(2)过氧化氢分子间,氧原子和氢原子间易形成氢键,H2O2能与水任意比混合,且纯净的H2O2具有较高的沸点,
故答案为:氢键;
(3)稀硫酸与Ba02反应来生成H2O2和硫酸钡沉淀,反应的化学方程式为:H2SO4+BaO2=BaSO4↓+H2O2,
故答案为:H2SO4+BaO2=BaSO4↓+H2O2;
(4)经测定H2O2为二元弱酸,酸性比碳酸还弱,不稳定易分解.已知Na2O2中通人干燥的C02不反应,但通人潮湿的CO2却可以产生O2,是水和CO2生成碳酸,依据强酸制弱酸的原理,碳酸再与Na2O2反应生成H2O2;H2O2不稳定,发生了分解生成氧气,反应的化学方程式为:Na2O2+CO2+H2O=Na2CO3+H2O2 2H2O2=2H2O+O2↑,
故答案为:Na2O2+CO2+H2O=Na2CO3+H2O2 2H2O2=2H2O+O2↑;
(5)2MnO4-+5H2O2+6H+=2Mn2++8H2O+5O2↑,用移液管吸取10.00mL的H2O2样品,置于100ml)容量瓶中,加水稀释至刻度线,取25.OOmL溶液置于锥形瓶再加入lOmL 3mol/L的稀硫酸(过量),用0.02mol/L的标准浓度的KMnO4溶液滴定,所用体积为20.00ml,
2MnO4-+5H2O2+6H+=2Mn2++8H2O+5O2↑,
2 5
0.02×0.02mol n(H2O2)
n(H2O2)=0.001mol
100ml溶液中含过氧化氢物质的量=$\frac{100}{25}$×0.001mol=0.004mol
原H2O2溶液的浓度=$\frac{0.004mol×34g/mol}{0.01L}$=13.6g/L;
故答案为:2MnO4-+5H2O2+6H+=2Mn2++8H2O+5O2↑;13.6.
点评 本题考查了过氧化氢结构、性质的分析应用,溶液浓度的测定方法,注意过氧化氢结构特点及性质,注意极性共价键与非极性共价键区别,题目难度中等.


 互动课堂系列答案
互动课堂系列答案 激活思维智能训练课时导学练系列答案
激活思维智能训练课时导学练系列答案科目:高中化学 来源: 题型:选择题
| A. | Ka=$\frac{2×1{0}^{-7}}{0.1V-2}$ | B. | V=$\frac{2×1{0}^{-7}}{0.1{K}_{a}-2}$ | ||
| C. | Ka=$\frac{2×1{0}^{-7}}{V+20}$ | D. | Ka=$\frac{2×1{0}^{-8}}{V}$ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 第IIIA的铊(Tl)既能与盐酸作用产生氢气,又能跟NaOH溶液反应放出氢气 | |
| B. | 第VIIA的砹(At)为有色固体,易溶于四氯化碳,但难溶于水 | |
| C. | 第IIA的锶的硫酸盐(SrSO4)是易溶于水的白色固体 | |
| D. | 第VIA的硒的氢化物(H2Se)是无色、有毒,比H2S稳定的气体 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题

| A. | 实验室用装置①制取氨气 | |
| B. | 装置②中X若为四氯化碳,可用于吸收氨气,并防止倒吸 | |
| C. | 装置③可用于制备氢氧化亚铁并观察其颜色 | |
| D. | 装置④b口进气可收集CO2等气体 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | abcd | B. | bcd | C. | acd | D. | abc |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
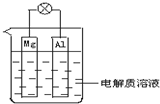 如图所示,组成一种原电池.试回答下列问题(灯泡功率合适):
如图所示,组成一种原电池.试回答下列问题(灯泡功率合适):查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com