
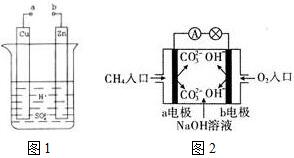
 原电池是化学对人类的一项重大贡献.
原电池是化学对人类的一项重大贡献.分析 (1)①a和b不连接时,该装置不构成原电池,锌和氢离子发生置换反应;
②a和b用导线连接,该装置构成原电池,锌失电子发生氧化反应而作负极,铜作正极,正极上氢离子得电子发生还原反应,电解质溶液中阳离子向正极移动;
③根据锌与转移电子之间的关系式计算;
(2)①碱性甲烷燃料电池中通入甲烷的一极为原电池的负极,通入氧气的一极为原电池的正极,负极上是燃料发生失电子的氧化反应;
②根据电池反应式确定溶液pH变化.
解答 解:(1)①a和b不连接时,该装置不构成原电池,锌和氢离子发生置换反应,离子反应方程式为:Zn+2H+=Zn2++H2↑,
故答案为:Zn+2H+=Zn2++H2↑;
②a和b用导线连接,该装置构成原电池,铜作正极,正极上氢离子得电子发生还原反应,锌失电子发生氧化反应而作负极,电极反应式为Zn-2e-=Zn2+;放电时,电解质溶液中氢离子向正极铜电极移动,
故答案为:Zn-2e-=Zn2+;还原;Cu;
③锌片减少的质量=$\frac{0.2mol}{2}$×65g/mol=6.5g,
故答案为:6.5;
(2)①碱性甲烷燃料电池中通入甲烷的一极a为原电池的负极,该极上是燃料发生失电子的氧化反应,通入氧气的一极为原电池的正极,发生得电子的还原反应,即O2+2H2O+4e-=4OH-,
故答案为:O2+2H2O+4e-=4OH-;
②在碱性溶液中,甲烷燃料电池的总反应式为CH4+2O2+2OH-=CO32-+3H2O,溶液中氢氧根离子被消耗,导致溶液的pH减小,
故答案为:减小.
点评 本题综合考查了原电池的内容,涉及电极判断与电极反应式书写等问题,做题时注意从氧化还原的角度判断原电池的正负极以及电极方程式的书写,本题中难点和易错点为电极方程式的书写,题目难度中等.


 智慧小复习系列答案
智慧小复习系列答案科目:高中化学 来源: 题型:选择题
 如图,烧杯中盛有等体积的水和煤油,现将一小块金属钠加入烧杯中,试推断能观察到的实验现象应是( )
如图,烧杯中盛有等体积的水和煤油,现将一小块金属钠加入烧杯中,试推断能观察到的实验现象应是( )| A. | 钠悬浮在煤油层中 | |
| B. | 钠静止在两液面之间 | |
| C. | 钠沉入水底下 | |
| D. | 钠熔化成闪亮的小球,在两液体界面附近上下跳动 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 实验序号 | 高锰酸钾溶液体积(ml) | 废水样品的体积(ml) |
| 1 | 10.02 | 25.00 |
| 2 | 10.62 | 25.00 |
| 3 | 9.98 | 25.00 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
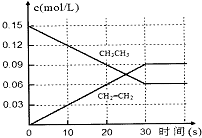 乙烯是重要的化工原料,用乙烷脱氢制乙烯:
乙烯是重要的化工原料,用乙烷脱氢制乙烯:| 化学键 | C-H | C-C | C=C | H-H |
| 键能(kJ.mol-1) | 412 | 348 | 612 | 436 |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
 X、Y、Z、W均为短周期元素,它们在元素周期表中的位置如图所示,Y是地壳中含量最多的元素,下列说法中正确的是( )
X、Y、Z、W均为短周期元素,它们在元素周期表中的位置如图所示,Y是地壳中含量最多的元素,下列说法中正确的是( )| A. | 非金属性:X>Y | |
| B. | 原子半径:Z>W>X>Y | |
| C. | 氢化物的沸点:Z>Y | |
| D. | W的单质能水反应,生成一种具有漂白性的物质 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | +1 | B. | +2 | C. | +3 | D. | +4 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 醋酸和碳酸钙反应:2H++CO32-═H2O+CO2↑ | |
| B. | 锌片插入硝酸根溶液中:Zn+Ag+═Zn2++Ag | |
| C. | 铜和稀硝酸反应:Cu+2NO3-+4H+═Cu2++2NO2↑+2H2O | |
| D. | 氯气和氢氧化钠溶液反应:Cl2+2OH-═Cl-+ClO-+H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 温度/K | 反应I | 反应II | 已知: K1>K2>K1′>K2′ |
| 298 | K1 | K2 | |
| 328 | K1′ | K2′ |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com